ÍNDICE
- 1 Resumen
- 2 Introducción
- 3 2. Fisiopatología de las enfermedades autoinmunes.
- 4 3. Significado terapéutico de los polifenoles
- 5 4. Estado clínico de los polifenoles en los trastornos autoinmunes.
- 6 EL VITILIGO
- 7 COLITIS ULCEROSA
- 8 SARCOIDOSIS
- 9 ESCLEROSIS MULTIPLE
- 10 5. Polifenoles dirigidos a diversas vías de señalización
- 11 6. Conclusión
Un estudio concluye que los polifenoles son beneficiosos en la prevención y el tratamiento de diversas enfermedades y especialmente las autoinmunes.
En enfermedades autoinmunes, muchos extractos de plantas o compuestos fenólicos individuales aislados se han evaluado por su eficacia en estudios clínicos. Entre ellos, se han estudiado los extractos de Ginkgo biloba y té verde por su eficacia en vitíligo, colitis ulcerosa, esclerosis múltiple, etcétera.
Del mismo modo, también se estudió la curcumina (de la cúrcuma), resveratrol, gallato de epigallocatequina por su eficacia en diversas enfermedades autoinmunes. En conjunto, los polifenoles han demostrado ser candidatos prometedores para el desarrollo de nuevas terapias en enfermedades autoinmunes y aún se están realizando más estudios sobre sus efectos terapéuticos sobre las enfermedades autoinmunitaras.
Resumen
Además de proteger al cuerpo de infecciones y enfermedades, el sistema inmunitario produce autoanticuerpos que pueden causar trastornos autoinmunes complejos, como diabetes tipo I, cirrosis biliar primaria, artritis reumatoide y esclerosis múltiple, por nombrar algunos.
En tales casos, el sistema inmune no reconoce entre agentes extraños y sus propias células del cuerpo. Diferentes factores, tales como factores genéticos (CD25, STAT4), factores epigenéticos (metilación del ADN, modificaciones de histonas) y factores ambientales (xenobióticos, medicamentos, hormonas) desencadenan la autoinmunidad. Los glucocorticoides, los medicamentos antiinflamatorios no esteroideos (AINEs), los agentes inmunosupresores y biológicos se utilizan actualmente para controlar las enfermedades autoinmunes de diferentes orígenes.
Sin embargo, la cura completa sigue siendo difícil de alcanzar. Muchos productos dietéticos y naturales, incluidos los polifenoles, se han estudiado ampliamente como posibles estrategias alternativas de tratamiento para el tratamiento de los trastornos autoinmunes.
Los polifenoles poseen una amplia gama de propiedades farmacológicas y terapéuticas, que incluyen actividades antioxidantes y antiinflamatorias. Como agentes inmunomoduladores, los polifenoles son herramientas farmacéuticas emergentes para el tratamiento de diversos trastornos autoinmunes, como el vitiligo, la colitis ulcerosa y la esclerosis múltiple (EM).
Los polifenoles activan vías intracelulares como la vía dependiente del ácido araquidónico, el factor nuclear kappa-potenciador de la cadena ligera de las células B activadas (NF-κB) vía de señalización, la ruta de las proteínas quinasas activadas por mitógeno (MAPKs), la fosfatidilinositol 3-quinasa / proteína quinasa B (PI3K / Akt) vía de señalización y modulación epigenética, que regulan la respuesta inmune del huésped.
Esta revisión oportuna analiza los supuestos puntos de acción de los polifenoles en las enfermedades autoinmunes, caracterizando su eficacia y seguridad como agentes terapéuticos en el manejo de los trastornos autoinmunes.
Introducción
El sistema inmune protege de infecciones y enfermedades que resultan de agentes bacterianos, virales y otros agentes causales. Sin embargo, bajo ciertas circunstancias, el sistema inmune puede producir autoanticuerpos contra sus propias células, lo que lleva a enfermedades autoinmunes. En tales casos, el sistema inmune no reconoce entre agentes extraños y las propias células del cuerpo [ 1 ]. Los sistemas complejos de inmunidad innata y adaptativa y su interacción con genes y factores ambientales desencadenan el desarrollo de enfermedades autoinmunes sistémicas [ 2 ].
Aunque se cree que es poco frecuente, hasta la fecha se han identificado más de 80 enfermedades autoinmunes, que incluyen hepatitis autoinmune, diabetes tipo I, cirrosis biliar primaria, artritis reumatoide, esclerosis múltiple, etc. [ 3]
Se cree que las enfermedades autoinmunes afectan al 8-10% de la población [ 4 ]. La edad de aparición de los síntomas puede diferir de una enfermedad autoinmune a otra. También hay muchos factores genéticos subyacentes para el desarrollo de estas enfermedades.1.
Enfermedades autoinmunes tratamiento
Las opciones de tratamiento convencionales y comunes para las enfermedades autoinmunes incluyen analgésicos, fármacos antiinflamatorios no esteroideos (AINE) y glucocorticoides [ 5 ]. Sin embargo, en los últimos años, la inmunosupresión terapéutica y los agentes biológicos también han demostrado ser beneficiosos en el tratamiento de los trastornos autoinmunes [ 4 ].
Sin embargo, mientras atenúa los síntomas inflamatorios o la progresión de las enfermedades, la cura general sigue siendo difícil de alcanzar. Los productos dietéticos naturales y las hierbas medicinales también se estudian ampliamente como posibles estrategias de tratamiento para enfermedades autoinmunes [ 6 – 9 ].
Los productos dietéticos naturales juegan un papel importante en el mantenimiento de la salud humana [ 10 ]. Los polifenoles son metabolitos secundarios en las plantas y hasta la fecha se han identificado más de 8,000 polifenoles [ 11 ]. Se encuentran comúnmente en frutas, vegetales de hojas, té, café y legumbres, por nombrar algunos [ 11 , 12 ]. Los polifenoles se pueden dividir en clases químicas de ácidos fenólicos, flavonoides, taninos, lignanos, estilbenos, etc., proporcionando protección en las plantas contra organismos patógenos [ 13 , 14 ], principalmente debido a sus propiedades antioxidantes y antiinflamatorias [ 11 , 15 ].
Muchos polifenoles, especialmente los flavonoides, poseen potentes propiedades antiinflamatorias [ 16 – 19 ]. y regular la inmunidad [ 6 , 7 , 17 , 20 – 22 ]. Varios productos naturales como el galato de epigalocatequina (EGCG) [ 23 ], el resveratrol [ 24 ], la curcumina y la capsaicina [ 25 ] han sido bien estudiados por su efecto beneficioso en las enfermedades autoinmunes, y serán el tema de esta revisión, resumiendo los datos clínicos sobre su eficacia en el tratamiento de enfermedades autoinmunes.
2. Fisiopatología de las enfermedades autoinmunes.
El sistema inmune ofrece un mecanismo de defensa, que proporciona tolerancia propia a las interacciones inofensivas, al tiempo que protege al organismo contra depredadores peligrosos como los patógenos (bacterias, virus, etc.) y las amenazas ambientales. La disfunción de este sistema, como la pérdida de tolerancia inmune y la reorganización inadecuada de la homeostasis, puede conducir a enfermedades autoinmunes (SIDA).
La prevalencia de SIDA es de alrededor del 5% en todo el mundo, y hasta la fecha se han reconocido 80 tipos diferentes de enfermedades autoinmunes [ 26 ]. Los factores genéticos, epigenéticos y ambientales (medicamentos, hormonas, nutrición, microbiota, apoptosis, xenobióticos y otros) son factores predisponentes para la autoinmunidad [ 27].
Las enfermedades autoinmunes sistémicas como el lupus eritematoso sistémico (LES), la psoriasis y la artritis reumatoide (AR) son causadas por la interacción de muchos autoantígenos, incluidas las moléculas de la superficie celular y las proteínas de la matriz intracelular con autoanticuerpos reactivos. Además, algunos trastornos específicos, como la diabetes tipo I (T1D), la esclerosis múltiple (EM) y Hashimoto, la enfermedad inflamatoria intestinal (EII) también pueden ocurrir debido a una respuesta inmune a los autoantígenos localizados dentro de un órgano en particular. Además, la presencia de SIDA puede afectar el desarrollo de otras enfermedades crónicas. Por ejemplo, los pacientes con enfermedades inflamatorias crónicas (como LES, AR) tienen un mayor riesgo que la población general de desarrollar tipos específicos de linfoma [ 28 ].
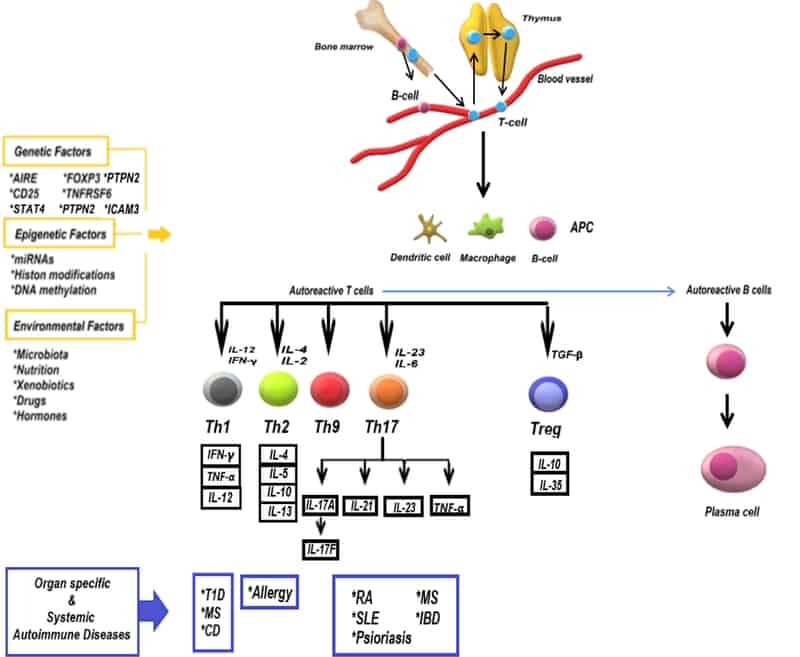
Los mecanismos efectores implicados en la producción de citocinas proinflamatorias y las células T cooperadoras autorreactivas (Th) son comúnmente responsables del inicio de la patogénesis autoinmune. Las células T auxiliares presentan las células T a las células B autorreactivas y, como consecuencia, las células B autorreactivas elaboran autoanticuerpos que causan inflamación de los tejidos. Las células crecen después de la interacción con un antígeno y proceden a diferenciarse en subconjuntos efectores (Th1, Th2, Th9 y Th17) y reguladores (Treg) [ 29 ]. Para mantener una homeostasis inmunológica efectiva, se requiere un equilibrio entre la activación de las células Th y la supresión mediada por las células Treg. La interrupción de este equilibrio provoca el desarrollo de una respuesta inmune por la producción de linfocitos y / o anticuerpos contra sus propias células y tejidos [ 30].] Además, el desequilibrio antes mencionado a favor de las células Th17 provoca un aumento significativo en la gravedad de la AID. Las células Treg modulan la actividad de las células Th y secretan citocinas inmunomoduladoras (interleucina (IL) -35 y 10) y factor de crecimiento transformante (TGF) -β), lo que induce tolerancia a los antígenos y conduce a la liberación de moléculas citotóxicas como la granzima y ejecutando. Además, IL-6 e IL-21 tienen un papel activo en el mantenimiento del equilibrio entre las células Th17 y las células Treg [ 31 ].
Los subgrupos de células T implicados en las respuestas inflamatorias son principalmente Th1 y Th17. Las células Th1 proporcionan protección contra las infecciones intracelulares mediante la secreción del factor de necrosis tumoral (TNF) -α y el interferón (IFN) -γ. Las células Th2 secretan citocinas, incluidas IL-4, IL-5, IL-10, IL-13, que a su vez atacan a los organismos parásitos y causan enfermedades alérgicas. Las células Th17, una de las principales poblaciones de células Th patógenas, requieren una serie de factores de transcripción (como NF-κB, STAT3) y citocinas específicas (como TGF-β, IL-6, IL-23) para su activación y proliferación. Además, secretan TNF-α e interleucinas, incluidas IL-17A, IL-17F, IL-21, IL-22. IL-17A e IL-17F, que juegan un papel clave en la fisiopatología de los AID, como RA, SLE e IBD,32 , 33 ].
El aumento inducido por IL-17 y TNF-α en la permeabilidad de la barrera intestinal facilita la fisiopatología de la enfermedad de Crohn (EC), la EII (colitis ulcerosa (CU) y la EM [ 34 , 35 ]). De manera similar, en la barrera intestinal-microbioma y conectividad cerebral, Se descubrió que el aumento de los niveles plasmáticos de LPS en pacientes con EM estaba relacionado con la producción de IL-6, la proliferación de células Th17 en el intestino y las diferencias de expresión en los genes asociados con la señalización de NF-kB [ 36 , 37 ].
La EII y el LES son enfermedades autoinmunes caracterizadas por un aumento de los niveles de las citocinas proinflamatorias IL-1 y LTB4 [ 38 ]. Además, la sobreexpresión de IL-6 conduce al desarrollo de AID al estimular la diferenciación de células B. Aunque la concentración sérica de IL-6 es mayor en CD en comparación con UC, la producción de citocinas derivadas de macrófagos (IL-1, IL-6 y TNF-α) en ambas enfermedades aumenta. Del mismo modo, los niveles de IL-6 también se elevaron en pacientes con diabetes tipo 1, AR y psoriasis [ 39 ].
Además, la estructura del heterodímero IL-23 que regula el desarrollo de las células T productoras de IL-17 e IL-22 también se asocia con la etiología de las enfermedades autoinmunes. Por ejemplo, se sabe que la psoriasis es el resultado de la activación del eje de citocinas IL-23 / Th17 [ 40 , 41 ]. Estudios recientes también han corroborado un papel para IL-27p28 en enfermedades asociadas con la autoinmunidad del SNC (sistema nervioso central), como la EM, donde suprime las funciones de las células efectoras Th1 y Th17 [ 42 ].
Las ayudas son el resultado de una combinación de predisposición genética y factores ambientales. De hecho, el trasfondo genético de los AID está estrechamente relacionado con el complejo principal de histocompatibilidad (MHC) denominado antígeno leucocitario humano (HLA). Se ha documentado la relación entre las moléculas de MHC de clase II (HLA-DR2b y HLA-DR4) y la mayor susceptibilidad a enfermedades, como la EM y la AR [ 43 ]. Del mismo modo, los AID comunes, como T1D, SLE, psoriasis, están asociados con alelos HLA específicos [ 44 ]. Además, las mutaciones genéticas AIRE (regulador autoinmune), TNFRSF6 (receptor 6 de la supe familia del receptor de TNF), Foxp3, CD25, PTPN2, IRF5, STAT4, ICAM3, BANK1 mostraron una fuerte relación con los AID [ 45 , 46 ].
Varios factores ambientales estimulan los componentes epigenéticos e intrínsecos que pueden alterar la función del gen y, por lo tanto, están asociados con las expresiones / funciones de las células inmunes. Los mecanismos epigenéticos (metilación del ADN, acetilación de histonas, microARN), en la influencia de factores ambientales, afectan la prevalencia de muchos AID. Estos mecanismos juegan un papel importante en la embriogénesis, la diferenciación celular, la inactivación del cromosoma X y la impresión genómica. En un reciente estudio de metilación de> 1.200 genes, se encontró que los patrones de metilación de los pacientes con osteoartritis son diferentes a los de los pacientes con AR [ 47 ].
Numerosos SIDA son más comunes en mujeres en edad reproductiva que en hombres debido a las hormonas sexuales y la inactivación del cromosoma X [ 48 ]. El LES representa un AID de origen epigenético caracterizado por el deterioro de la metilación del ADN de las células T. La razón de la mayor incidencia en las mujeres es la desmetilación de CD40LG en el cromosoma X inactivo y sobreestimulado de las células B para producir inmunoglobulina G (IgG) [ 49 ].
Los factores que influyen en el desarrollo de la autoinmunidad se resumen en Figura 1.
3. Significado terapéutico de los polifenoles
Los polifenoles son los fitoquímicos más abundantes en la dieta humana con potencial antioxidante [ 50 ]. Los polifenoles tienen un papel dinámico como antimicrobianos (contra virus, bacterias y hongos) [ 51 ], cardioprotectores [ 52 ], antiasma [ 53 ], antidepresivos y ansiolíticos [ 54 ], antidiabéticos [ 55 ], neuroprotectores [ 56 ] anticancerígenos [ 57 ], a nombrar unos pocos. Sus propiedades antioxidantes se vuelven invulnerables en el tratamiento de enfermedades relacionadas con la edad [ 58 , 59 ].
Dadas sus actividades inmunomoduladoras, los polifenoles se han convertido en herramientas farmacéuticas para el tratamiento de diversos trastornos de autoinmunidad [ 60 ]. Actualmente, se usa una combinación de medicamentos en el tratamiento de trastornos autoinmunes como la artritis reumática [ 61 ]. Dichas combinaciones de fármacos, por ejemplo, DMARD en la artritis reumática, proporcionan efectos sinérgicos y reducen los efectos secundarios asociados con fármacos individuales; Sin embargo, los resultados han sido decepcionantes. Además, se ha demostrado que la vacunación es eficaz en el tratamiento de varios trastornos autoinmunes [ 62 ], por lo tanto, se requieren más efectos.
4. Estado clínico de los polifenoles en los trastornos autoinmunes.
Los trastornos autoinmunes se han clasificado en varios tipos, y se han identificado aproximadamente 80 de esas enfermedades. Se han realizado varios ensayos clínicos sobre el efecto beneficioso de los polifenólicos en las enfermedades autoinmunes y sus complicaciones.
EL VITILIGO
El vitíligo es uno de los trastornos cutáneos comunes que se caracteriza por hipopigmentación con problemas y problemas psiquiátricos importantes si ocurre antes de la edad adulta. Recientemente, se realizó un ensayo clínico piloto abierto con 12 adolescentes (de 12 a 18 años) utilizando polvo de Ginkgo biloba [ 63 ].
Se sabe que el Ginkgo biloba es una rica fuente de polifenoles [ 64 ]. G. biloba se administró en dosis de 60 mg BID, es decir, dos veces al día durante 12 semanas. El Grupo de trabajo europeo Vitíligo (VETF) y el Índice de puntuación del área de Vitiligo (VASI) se utilizaron para acceder a la efectividad del extracto de Ginkgo biloba, mientras que los factores de coagulación sérica (plaquetas, PTT, INR) al inicio y la semana 12 se usaron para acceder a otros parámetros incluso.
El tratamiento da como resultado una despigmentación completa, una disminución del 0.4% en el área de lesión de vitiligo total de VETF y una mejora de la puntuación de VASI total, la puntuación de estadificación de VETF, la puntuación de propagación de VETF en 0.5, 0.7 y 3.9 respectivamente. No se informaron cambios significativos en los factores de coagulación.
La eficacia del tratamiento con G. biloba se probó en la difusión lenta del vitiligo en un ensayo doble ciego controlado con placebo. Un total de 47 pacientes (incluido el placebo) recibieron 40 mg de extracto de G. biloba tres veces al día [ 65 ].
En comparación con el placebo, el extracto de Ginkgo biloba se asoció con la detención de la enfermedad, señalando que detuvo la progresión de la enfermedad del vitiligo al reducir la despigmentación y promover la repigmentación.
COLITIS ULCEROSA
La curcumina (principio activo de la cúrcuma), un compuesto fenólico natural, tiene múltiples usos. La curcumina fue examinada por su efectividad para mantener la remisión de la colitis ulcerosa [ 66 ]. En un estudio aleatorizado, doble ciego, controlado con placebo, 50 pacientes con colitis ulcerosa activa de leve a moderada ya tratados con mesalamina, recibieron cápsulas de curcumina 3 g / día durante 1 mes. Se concluyó que el 53.8%, es decir, 14 pacientes alcanzaron la remisión clínica de la enfermedad en la semana 4, en comparación con ninguno en el tratamiento con placebo. La respuesta clínica se logró en un 65,3% (17 pacientes) en el grupo tratado con curcumina en comparación con el 12,5% (3 pacientes) en el grupo placebo.
SARCOIDOSIS
La quercetina, una clase de flavonoides del compuesto polifenólico, se probó por su efecto beneficioso para reducir el estrés oxidativo y la inflamación en la sarcoidosis. Se realizó un ensayo clínico aleatorizado doble ciego controlado con placebo en 18 pacientes con sarcoidosis no tratados. Se administró quercetina a una dosis de 4 × 500 mg en 24 h. El tratamiento con quercetina aumentó la capacidad antioxidante plasmática total. Los marcadores oxidativos e inflamatorios (malondialdehído, TNFα / IL-10 e IL-8 / IL-10) también se regularon negativamente en pacientes con sarcoidosis después del tratamiento con curcumina.
ESCLEROSIS MULTIPLE
La esclerosis múltiple (EM) es una de las enfermedades autoinmunes de origen neurológico caracterizada por fatiga y debilidad muscular. En uno de los estudios, se examinó la respuesta metabólica a Galato de epigalocatequina – EGCG y la utilización de sustrato en pacientes con EM [ 67].
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 8 pacientes con esclerosis múltiple remitente recurrente. Se administró una dosis de EGCG (600 mg / día) durante 12 semanas. En reposo, el gasto de energía posprandial y la oxidación de carbohidratos, así como el suministro de glucosa y la perfusión del tejido adiposo fueron significativamente menores en los hombres, pero mayores en las mujeres que recibieron EGCG en comparación con el placebo.
Durante el ejercicio, se informó que el gasto de energía posprandial fue menor después de la ingesta de EGCG en comparación con el placebo. Después del placebo, el ejercicio EE fue impulsado principalmente por la oxidación de grasas tanto en hombres como en mujeres. Después de EGCG, hubo un cambio a una oxidación de carbohidratos más alta y más estable durante el ejercicio en hombres, pero no en mujeres.
5. Polifenoles dirigidos a diversas vías de señalización
Los polifenoles destacan por su capacidad antioxidante, lo que les permite reducir los efectos negativos de las especies reactivas producidas por la sobreactivación del sistema inmune cuando hay una enfermedad autoinmune.
Además, los polifenoles son compuestos farmacológicamente activos con actividad inmunomoduladora [ 60]. Sin embargo, uno de los problemas enfrentados al evaluar su actividad farmacológica es la gran diversidad estructural de este grupo de compuestos y la alta variabilidad en su biodisponibilidad y metabolismo secundario al que están sujetos.
Además, cada tipo de polifenol se dirige a diferentes células inmunes y, por lo tanto, desencadena una gran cantidad de diversas vías de señalización intracelular que finalmente regulan la respuesta inmune del huésped. La modulación de varias vías de señalización conduce a alteraciones en la expresión de genes proinflamatorios, por ejemplo, los que codifican multitud de citocinas, ciclooxigenasa (COX), lipoxigenasa (COX), fosfolipasa A 2 (PLA 2), la isoforma inducible de óxido nítrico sintetasa (iNOS), que combinada con su capacidad para modular la población y la diferenciación de células inmunes específicas y su actividad antioxidante y antiinflamatoria directa permiten la regulación del proceso inflamatorio (Tabla 2) [ 68 , 69 ]. Hasta la fecha, la mayoría de los estudios mecanicistas se realizaron en cultivos celulares dada su mayor simplicidad y reproducibilidad; sin embargo, no recapitulan muchos de los problemas inherentes a la administración oral, la biodisponibilidad y el intenso metabolismo secundario al que están sujetos los polifenoles. Los puntos de acción propuestos de los polifenoles en los trastornos autoinmunes se resumen en la Figura 2.
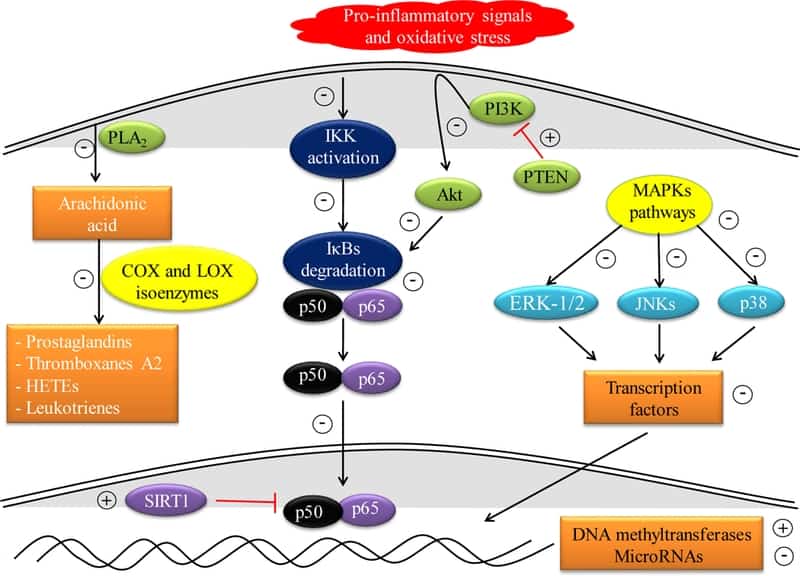
5.1. Vía dependiente del ácido araquidónico
El ácido araquidónico o ácido eicosatetraenoico (AA) es un ácido graso poliinsaturado de la serie omega-6 presente en los fosfolípidos de membrana, desde donde se libera por la acción del PLA 2 . Una vez en el citoplasma, varias enzimas como COX y LOX se dirigen al AA para generar prostaglandinas (PG) y tromboxanos A 2 o ácidos hidroxieicosatetraenoicos (HETEs) y leucotrienos (LT), respectivamente [ 69 ]. Estas moléculas son mediadores de lípidos que contribuyen al proceso inflamatorio y, por inferencia, su inhibición representa un objetivo terapéutico para la reducción de la inflamación. En consecuencia, uno de los mecanismos por los cuales los polifenoles pueden modular la respuesta inmune es mediante la inhibición directa de estas enzimas proinflamatorias [ 70].
Considerando el PLA 2 como la primera enzima en la cascada de AA, se ha demostrado la capacidad inhibitoria de los polifenoles como la quercetina, el kaempferol y la galangina, así como algunas antocianidinas (cianidina, delfinidina malvidina, peonidina y petunidina) [ 71 – 73 ].
El catecol (1,2-dihidroxibenceno) se une al PLA2 evitando que el sustrato entre en el sitio activo [ 74 ]. Además, el resveratrol y el ácido p-cumarico interactúan directamente con los residuos catalíticos de PLA2, bloqueando su actividad catalítica [ 75 ]. Un estudio interesante mostró que la quercetina y el honokiol inhibían la fosforilación y activación citosólica de PLA2 en células diferenciadas de neuroblastoma SH-SY5Y [ 76]] En cuanto a las enzimas COX y LOX, las flavonas son predominantemente inhibidores de COX, mientras que los flavanoles son preferentemente inhibidores de LOX [ 77 ]. Así, los flavonoides, como la luteolina, la galangina, la morina y la apigenina, ejercen notables efectos inhibidores de la COX [ 78 , 79 ]. Los flavanoles, que incluyen quercetina, kaempferol, miricetina y morina, a su vez, inhiben las enzimas LOX [ 80 ].
5.2. Vía de señalización de NF-κB
NF-κB regula la expresión de una amplia gama de genes implicados en el proceso inflamatorio, incluida la forma inducible de COX (COX-2), citocinas proinflamatorias [TNFα, IL-1, IL-2, IL-6 e IL- 8], quimiocinas [MCP-1, es decir, proteína quimioatrayente de monocitos 1, MIP-1α, es decir, proteína inflamatoria de macrófagos, CXCL1, es decir (motivo CXC), ligando 1 e IL-18], moléculas de adhesión [VCAM-1, es decir, proteína de adhesión celular vascular 1 , ICAM-1, es decir, la molécula de adhesión intercelular 1] y diversos factores de crecimiento e inmunorreceptores [ 81 , 82 ].
Los polifenoles pueden alterar la vía NFκB a lo largo de múltiples pasos en la cascada de señalización. Habida cuenta de su acción antioxidante, los polifenoles pueden reducir los niveles de especies reactivas, principalmente H 2 O 2, reduciendo así la activación de la vía [ 83 ]. Por lo tanto, se puede suponer que estas especies pueden actuar como mensajeros secundarios que facilitan la activación de la vía NFκB por un proceso sensible a la redox [ 84 ].
Además, los polifenoles pueden bloquear la fosforilación y la posterior degradación de las proteínas inhibidoras (IκBs) al alterar la activación de la quinasa IκBs (IKK) y prevenir la translocación nuclear y la unión del factor al ADN [ 85 ]. Los diferentes polifenoles que incluyen resveratrol, quercetina, genisteína o epigalocatequina-3-galato (EGCG) pueden inhibir la vía NFκB. El resveratrol bloquea la activación de NF-κB en las células RAW 264.7 de macrófagos cuando se estimula con LPS evitando la activación de IKK y la fosforilación de IκB [ 86] Además, el resveratrol puede interferir con la oligomerización de TLR4, un paso necesario en la activación del receptor [ 86 ].
Además, el resveratrol y la oleuropeína aglicona e hidroxitirosol reducen significativamente la activación de NFκB en las células endoteliales de la vena umbilical humana (HUVEC) estimuladas con LPS según lo determinado por el ensayo de cambio de movilidad electroforética [ 87].] Al estudiar varios modelos de células inmunes (macrófagos RAW264.7 y macrófagos derivados de la médula ósea, mastocitos humanos HMC-1, microglia BV-2 de ratón y HUVEC de ratón), se han informado los efectos inhibitorios de la quercetina en la activación de NFκB, incluida una reducción en la translocación nuclear de las subunidades p50 y p65, una inhibición de la fosforilación de IκBα y su consiguiente degradación, y un bloqueo de la activación de IKK. Se ha demostrado que la genisteína reduce la sobreproducción de TNFα e IL-6 en macrófagos RAW 264.7 estimulados por LPS mediante la inhibición de la activación de NFκB [ 92].
El mecanismo de acción se asoció con el bloqueo de la expresión de IKK, la degradación de IκBα y la translocación de p65 en el núcleo. Se observaron resultados análogos en células sinoviocíticas humanas MH7A estimuladas con TNFα al prevenir la fosforilación de IKK y la translocación de NFκB [ 93 ]. EGCG también evitó la activación de IKK e inhibió la fosforilación de la subunidad p65 de NFκB en un epitelio respiratorio humano A549 células estimuladas por IL-1β [ 94 ]. Este efecto parece estar mediado inicialmente por la inhibición de la degradación de IRAK (quinasa asociada al receptor de IL-1β mediada por IL-1β), que impide la activación de IKK. La inhibición en la activación de NFκB también se ha documentado en condrocitos de osteoartritis primaria estimulados con IL-1β [ 95 ].
5.3. Vía de las proteínas quinasas activadas por mitógenos (MAPK)
Las MAPK comprenden un grupo de serina / treonina proteína quinasas activadas principalmente por el estrés, mitógenos y factores de crecimiento con un papel central en muchos procesos celulares, incluida la regulación de genes relacionados con la inflamación [ 96] El efecto potencial de los polifenoles sobre las MAPK depende del propio polifenoles, así como de la célula objetivo. Varios estudios han informado de un efecto inhibitorio de los polifenoles sobre las JNK (c-Jun amininasas terminales terminales), ERK-1/2 (quinasas reguladas por señal extracelular), p38 / SAPK (proteínas quinasas activadas por el estrés). Estos efectos inhibitorios dan como resultado una disminución de la expresión y la liberación de mediadores proinflamatorios, como TNFα o moléculas de adhesión. Por ejemplo, se ha demostrado que la quercetina interfiere con la fosforilación y activación de JNK en macrófagos RAW 264.7 tratados con LPS, evitando así que la proteína activadora 1 (AP-1) se una al ADN e inhibiendo la transcripción de TNFα [ 98 ]. Además, la inhibición de la activación de ERK1 / 2 y p38 también se ha informado en respuesta a la quercetina [ 98 ,99 ] Corroborando este estudio, se ha informado una reducción en las formas fosforiladas de ERK1 / 2 y p38 en un modelo experimental en ratas de estudio de miocarditis autoinmune tras el tratamiento con quercetina [ 100 ]. Estudios adicionales informaron sobre los efectos inhibitorios de EGCG contra MAPK al reducir su fosforilación y activación, incluidos los macrófagos activados por LPS o la maduración de células dendríticas murinas inducidas por LPS [ 101 – 103 ].
También se ha demostrado que EGCG atenúa los síntomas asociados con un modelo murino para el síndrome de Sjogren autoinmune humano al reducir la fosforilación de p38 en las células acinares salivales [ 104 ]. El tratamiento con resveratrol inhibió las vías de señalización de p38 y JNK en células sinoviales RSC-364 de rata estimuladas con IL-1β y en HUVEC tratadas con peróxido de hidrógeno [ 105 , 106] Del mismo modo, se ha demostrado que otros polifenoles, como la luteolina, la crisina, la hesperidina, el naringina y el kaempferol, reducen la inflamación al interferir con las vías de las MAPK [ 107 – 109 ]. Sin embargo, los efectos opuestos, que informan sobre la activación de las vías de señalización de ERK y JNK en células endoteliales de arterias coronarias humanas cultivadas por quercetina y catequina que dan como resultado una regulación negativa del inhibidor del activador de plasminógeno 1 (PAI-1) [ 110 ], son notables y enfatizan la necesidad para caracterización futura sobre la eficacia de los polifenoles en la afectación de la señalización de MAPK.
5.4. Vía de señalización de fosfatidilinositol 3-quinasa / proteína quinasa B (PI3K / Akt)
La vía de señalización de PI3K / Akt juega un papel importante en la expresión de mediadores proinflamatorios al inducir la degradación de IκB y la siguiente activación de NFκB [ 111 ]. Diversos polifenoles median sus efectos antiinflamatorios, en parte, a través de la inhibición de PI3K / Akt. La expresión de la citocina proinflamatoria IL-17 se redujo mediante el tratamiento con resveratrol en fibroblastos cardíacos en un proceso mediado por la inhibición de PI3K / Akt [ 112 ]. El resveratrol también suprimió la actividad de PI3K / Akt en los tenocitos humanos activados por IL-1β [ 113 ]. La quercetina suprimió la fosforilación de Akt mediante unión directa e inhibición de PI3K en células epidérmicas de ratón JB6 [ 114].
La silibinina, aplicada tópicamente a los oídos murinos inflamados, suprimió la expresión de citocinas proinflamatorias y COX-2 por inhibición de PI3K / Akt [ 115 ]. EGCG inhibió la transición e inflamación epitelial-mesenquimal a través de la vía PI3K / AKT al regular la expresión de homólogo de fosfatasa y tensina (PTEN). Dado que esta enzima bloquea la activación de PI3K a través de la desfosforilación de la señalización de los lípidos fosfatidilinositol-3,4,5-trifosfato [ 116 ]. Otro estudio informó sobre la eficacia protectora de la isorhapontigenina contra la inflamación de las células epiteliales de las vías respiratorias al suprimir la vía PI3K / Akt y reducir la activación de NFκB y la liberación de IL-6 y quimiocina CXCL8, es decir (motivo CXC) ligando 8 [ 117 ].
Es de destacar que los efectos favorables de los polifenoles también pueden estar asociados con una mayor señalización en la vía PI3K / Akt. En estos estudios, prevalece la activación de la vía como mecanismo de señalización para la supervivencia. Por ejemplo, se demostró que el ácido elágico protege a los HUVEC de la apoptosis inducida por el tratamiento con lipoproteínas de baja densidad oxidadas en un proceso mediado por la activación de PI3K / Akt [ 118 ]. Además, el resveratrol indujo la neuroprotección en ratas sometidas a daño cerebral inducido por isquemia / reperfusión al activar la vía de supervivencia PI3K / Akt [ 119 ].
5.5. Modulación epigenética
Un nuevo punto para el control celular de los polifenoles es secundario a su capacidad para modular mecanismos epigenéticos modulares como la metilación del ADN, las modificaciones de histonas y la regulación postranscripcional por microARN, modulando la activación y diferenciación de las células inmunes. Se han evidenciado cambios en los patrones epigenéticos en enfermedades que incluyen trastornos inflamatorios [ 120 ].
De hecho, una serie de estudios ha informado de la existencia de modificaciones epigenéticas inducidas por polifenoles, que conducen a la activación o silenciamiento de genes en ausencia de cambios en las secuencias de ADN [ 121 , 122 ]. Entre los diversos polifenoles, se ha demostrado que el resveratrol es un fuerte activador de SIRT1, lo que resulta en la inhibición de NFκB y sus genes posteriores, como COX-2 e iNOS [123 , 124 ].
Además, otros varios polifenoles, como la quercetina, la curcumina, la miricetina y la fisetina, también activan la SIRT1 [ 125 – 128 ]. EGCG ha demostrado reducir la actividad de NFκB mediante hipoacetilación de p65 al inhibir la actividad de la histona acetil transferasa [ 129 , 130 ]. Además de SIRT1, el resveratrol también actúa sobre las metiltransferasas de ADN, aumentando su expresión y actividades [ 131 ]. También se ha informado que la curcumina reactiva el gen de la neprilisina (un fuerte inhibidor de Akt) a través de la desmetilación de CpG, lo que conduce a la inhibición de Akt y la posterior inhibición de NFκB en células de neuroblastoma N2a de ratón [132].
Los microARN son ARN reguladores pequeños y no codificantes con la capacidad de regular la translocación y / o degradación de los ARN mensajeros [ 133 ]. Diversos estudios informaron los efectos moduladores de los polifenoles en los microARN. Sin embargo, aunque algunos estudios han demostrado los efectos antiinflamatorios de la modulación de los microARN, la mayoría de las investigaciones se han centrado en este contexto en los resultados del cáncer. Se ha encontrado que la curcumina aumenta la expresión de miR-181b, lo que, a su vez, reduce la expresión de las quimiocinas proinflamatorias CXCL1 y CXCL2 [ 134 ]. Otro microARN interesante es el miR-21, ya que se ha asociado con la actividad de NFκB [ 133 ]. Se ha demostrado que el resveratrol disminuye la expresión de miR-21 y la actividad de NFκB en las células tumorales cerebrales U251 [135 ]. También se ha informado que el resveratrol aumenta miR-Let7A en las células THP-1 estimuladas con LPS, lo que resulta en una expresión reducida de IL-6, IL-10 y TNFα [ 136 ]. En otro estudio realizado en el modelo de adenoma pulmonar de ratones A / J, se ha demostrado que EGCG aumenta 12 microARN y disminuye 9 genes diana asociados con elementos clave de las vías de señalización de Akt y MAPK [ 137 ].
6. Conclusión
Los polifenoles, uno de los principales metabolitos secundarios en las plantas, son beneficiosos en la prevención y el tratamiento de diversas enfermedades. En enfermedades autoinmunes, muchos extractos de plantas o compuestos fenólicos individuales aislados han sido evaluados por su eficacia en estudios clínicos. Entre ellos, extractos de G. bilobay el té verde fueron estudiados por su efectividad en vitiligo, colitis ulcerosa, esclerosis múltiple, etc. De manera similar, la curcumina, el resveratrol, el galato de epigalocatequina también fueron estudiados por su eficacia en diversas enfermedades autoinmunes. Tomados en conjunto, los polifenoles se han mostrado como candidatos prometedores para el desarrollo de nuevas terapias en enfermedades autoinmunes. Si bien se han realizado pocos estudios basados en mecanismos sobre su mecanismo de acción en enfermedades autoinmunes, aún no se han delineado por completo.
Tal vez te interese
La dieta antiinflamatoria
- Leer artículo La dieta antiinflamatoria
- Libro La Dieta Antiinflamatoria: La dieta para la que la evolución te ha preparado
COMPARTE SI TE GUSTÓ: Detrás de cada artículo hay trabajo, investigación y tiempo dedicado hasta su publicación. Si te fue útil o te gustó, te agradeceré que lo compartas con otras personas a las que también pueda interesar o dejes tus comentarios en este blog.
Referencias
Algunas imágenes para ilustrar este post fueron tomadas de Freepik.es y de Pixabay.com. Nuestro agradecimiento.


