ÍNDICE
La ingesta de polifenoles podría usarse como un tratamiento exitoso en la EC y la CU.
Numerosos estudios han demostrado que el consumo de fibra, polifenoles y ácidos grasos, así como mantener una dieta baja en carbohidratos, en pacientes con enfermedad de Crohn y colitis ulcerosa, puede mejorar la calidad de vida y conducir a la remisión de la enfermedad.
Estudios recientes han investigado la combinación de tratamiento farmacológico junto con intervenciones nutricionales para mejorar la calidad de vida y el riesgo de recaída de la enfermedad.
Algunas dietas han mostrado ser efectivas para el control y remisión de las Enfermedades Inflamatorias Intestinales como:
- La dieta específica de carbohidratos (SCD)
- La dieta baja en FODMAPs
- La dieta paleolítica (dieta paleo)
- y la Dieta antiinflamatoria (IBD-AID) [ 8 ].
El paciente de Colitis Ulcerativa, Enfermedad de Crohn o Microcolitis ulcerosa encontrará interesante este estudio de los suplementos dietéticos y sus efectos sobre la enfermedad inflamatoria intestinal, basados en la evidencia científica avalada por esta revisión bibliográfica.
Resumen
Las enfermedades inflamatorias del intestino, incluidas la enfermedad de Crohn y la colitis ulcerosa, son un problema crónico y recurrente de por vida que afecta a 11.2 millones de personas en todo el planeta.
Hasta la fecha, existe un tratamiento para la enfermedad inflamatorial intestinal, una terapia farmacológica para tratar síntomas como diarrea, estreñimiento y calambres / dolor abdominal. Estos medicamentos también ayudan a aliviar las molestias cotidianas; Sin embargo, no hay terapias curativas.
Estudios recientes han investigado la combinación de tratamiento farmacológico junto con intervenciones nutricionales para mejorar la calidad de vida y el riesgo de recaída de la enfermedad.
Los suplementos dietéticos, específicamente los probióticos, los polifenoles, las fibras, los ácidos grasos y las dietas de oligosacáridos, disacáridos, monosacáridos y poliol de baja fermentación (dietas FODMAP), se han examinado detenidamente para determinar su efecto, si lo hubiera. sobre el desarrollo de la enfermedad inflamatoria intestinal y su curso de progresión.
Aproximadamente 30 estudios fueron cuidadosamente revisados y analizados para apreciar el valor de estos suplementos mencionados y su influencia en esta enfermedad gastrointestinal.
Después del análisis, se ha demostrado que el consumo de fibra, polifenoles y ácidos grasos, así como mantener una dieta baja en sacáridos para aquellos pacientes con enfermedad de Crohn y colitis ulcerosa, puede mejorar la calidad de vida e invocar la remisión clínica.
Algunos polifenoles, específicamente la curcumina y el resveratrol, han demostrado disminuir la actividad de la enfermedad en los estudios revisados.
Aunque estos estudios se han convertido en un tema de reciente interés, sería de gran valor para médicos y pacientes por igual, continuar en esta dirección de investigación y mejorar los hallazgos para las mejores sustancias y dosis de tratamiento. Esto conduciría a una mayor calidad de vida y al control de la enfermedad, lo que llevaría a menos complicaciones en el futuro.

Introducción a suplementos para Crohn y Colitis Ulcerosa
La enfermedad inflamatoria intestinal (EII) es un problema de por vida en todo el mundo. Ha sido definido por el Centro de Control de Enfermedades (CCE) como inflamación crónica del tracto gastrointestinal e incluye la enfermedad de Crohn y la colitis ulcerosa [ 1 ].
Se ha estimado que la EII afecta a alrededor de 11,2 millones de personas en todo el mundo, con una mayor prevalencia en Europa y América del Norte [ 2 ]. Se sabe que la EII afecta a las mujeres un poco más que a los hombres, y generalmente a las personas de 10 a 35 años, con una ligera prevalencia en los blancos no hispanos [ 3].
La EII se ha dividido en dos subtipos: colitis ulcerosa (CU) y enfermedad de Crohn (EC). Si bien la enfermedad presenta características clínicas similares en ambos subtipos, existen algunas características diferentes que son esenciales para un tratamiento adecuado. Yangyang y Rodríguez han enumerado los siguientes síntomas: diarrea, estreñimiento, dolor o sangrado rectal, urgencia de defecar, tenesmo, calambres abdominales y náuseas o vómitos [ 4].
Sin embargo, hay algunas diferencias clave que distinguen los CCE. Específicamente, la EC puede afectar cualquier parte del tracto gastrointestinal (GI), pero con mayor frecuencia afecta el intestino delgado. Las áreas dañadas aparecen en parches y el proceso inflamatorio puede llegar a través de las capas de las paredes del tracto gastrointestinal.
Por otro lado, la CU ocurre en el intestino grueso con áreas continuas dañadas, generalmente comenzando en el recto y extendiéndose más hacia el colon. Esta inflamación solo se presenta en la capa más interna del revestimiento del colon [ 5 ]. Los cambios microbianos intestinales también se pueden ver en la EII crónica, como la composición microbiana alterada y las anomalías bioquímicas sistémicas. Los abscesos de las criptas se ven en la CU, mientras que la EC generalmente tiene una apariencia de «adoquín» en la vista endoscópica.
Muchos científicos han estado buscando la causa de esta enfermedad; sin embargo, no se ha identificado tal causa. Todo lo que se sabe es que es el resultado de un sistema inmunitario inadecuado y que la genética también juega un papel clave en el desarrollo de esta enfermedad.
El World Journal of Gastroenterology ha declarado que «aunque la etiología de la EII sigue siendo en gran medida desconocida, implica una interacción compleja entre los factores genéticos, ambientales o microbianos y las respuestas inmunes» [ 2 ]. Si bien aún no se ha educado sobre las causas de esta enfermedad algo debilitante, algunas opciones de tratamiento han demostrado ser bastante efectivas, con el objetivo de lograr la remisión clínica y endoscópica.
Muchos medicamentos inmunosupresores han demostrado ser eficaces en el tratamiento de los síntomas de la EII [ 6] Estos incluyen esteroides, inmunomoduladores (tiopurinas, metotrexato) y productos biológicos como agentes alfa anti-factor de necrosis tumoral (anti-TNF) 4 integrinas y agentes anti-IL-12/23 [ 6 ].
A pesar de la competencia de estos tratamientos, deben ser personalizados para cada paciente. La personalización del tratamiento se realiza probando biomarcadores como la calprotectina (Cal), la proteína C reactiva en suero (PCR), la lactoferrina fecal (Lf) y la elastasa de neutrófilos polimorfonucleares (PMN-e), especialmente utilizados para diferenciar las patentes de EII de las personas con síndrome del intestino irritable. (SII) [ 7].
Se han esbozado algunas dietas que han mostrado algunos resultados en la Enfermedad Inflamatoria Intestinal como:
- La dieta específica de carbohidratos (SCD)
- La dieta baja en FODMAP (Fermentable Oligosacáridos Disacáridos Monosacáridos y Polioles)
- La dieta paleolítica (dieta paleo)
- y la Dieta antiinflamatoria (IBD-AID) [ 8 ].
A pesar de que estos han mostrado alguna mejora en los síntomas y el manejo de la EII, algunas sustancias específicas deben analizarse para conocer sus beneficios o inconvenientes en el curso de la EII. Tales sustancias son: los probióticos, polifenoles, la fibra, ácidos grasos, así como ciertas dietas bajas en FODMAP que se discutirán.
El impacto de los probióticos en el origen de la EII
Los probióticos son un tema de discusión muy común entre los profesionales de la salud de hoy. A menudo, se prescriben al mismo tiempo que los antibióticos para garantizar el reemplazo de la microflora intestinal después de ingerir antibióticos algo dañinos, pero necesarios.
Sin embargo, ha habido un interés reciente en los probióticos para mejorar los síntomas de la EII y alterar el curso de la enfermedad. Los probióticos, en general, se definen como ingredientes alimenticios hechos de bacterias vivas que, cuando se ingieren en cantidades adecuadas, cambian la microbiota y conducen a un beneficio para la salud del huésped.
Los pacientes con EII sufren una pérdida de flora intestinal que puede afectar el curso de la enfermedad. «Varios estudios han encontrado un desequilibrio en la microbiota intestinal en pacientes con EII en comparación con los controles sin EII con una pérdida general de diversidad [9,10].
Estos resultados sugieren una correlación entre los probióticos y el curso de la enfermedad. Sin embargo, estos resultados no parecen consistentes con todos los tipos de microbiota intestinal. Curiosamente, se observó un resultado sorprendente. Aunque hubo un aumento de Bifidobacterium y el grupo Lactobacillus en pacientes con EC y CU activos, estos hallazgos no diferían significativamente del grupo sano.
Los científicos también descubrieron que los niveles del grupo Clostridium coccoides se redujeron drásticamente en las heces de los pacientes activos con CU y EC.
Se ha informado que este grupo bacteriano afecta a su huésped de varias maneras. Específicamente, produce butirato que contribuye a la prevención de la inflamación, así como a la motilidad colónica.
También se ha observado que Clostridium coccoides induce la producción de células T reguladoras en los colon de los ratones, lo que sugiere que estas bacterias juegan un papel crítico en la homeostasis inmunológica [11].
La Escherichia coli también se encontró en abundancia en ambos tipos de pacientes con EII, sin embargo, una mayor proporción en los pacientes con CU activa [12]. La presencia de Escherichia coli en el intestino es conocida por promover la homeostasis intestinal y es usada como una medida preventiva contra la colonización de patógenos [13].
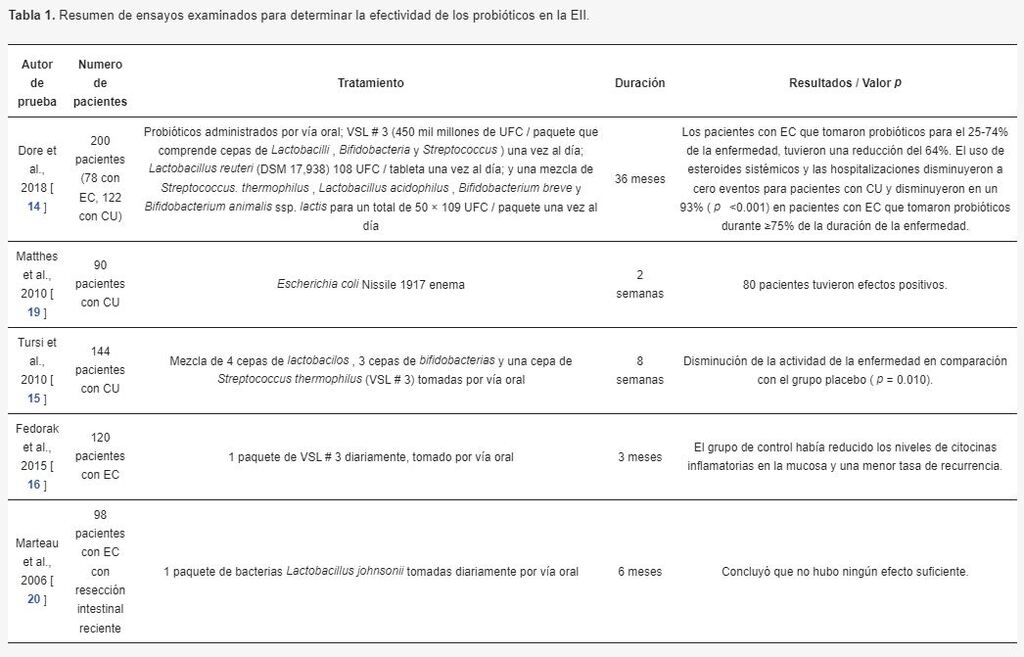
Recientemente, Dore y otros publicaron un estudio de cohorte en el que informaron de que no había necesidad de esteroides sistémicos, hospitalización y cirugía en aquellos pacientes con CU que estaban tomando probióticos más del 75% de la duración de la enfermedad y se observó una disminución del 93% en los pacientes con EC [14].
Los probióticos consumidos fueron los siguientes: VSL#3 (450.000 millones de UFC/paquete compuesto por cepas de Lactobacilli, Bifidobacteria y Streptococcus) una vez al día, Lactobacillus reuteri (DSM 17.938) 108 UFC/comprimido una vez al día, y una mezcla de Streptococcus thermophilus, Lactobacillus acidophilus, Bifidobacterium breve y Bifidobacterium animalis ssp. lactis para un total de 50 × 109 UFC/paquete una vez al día. Matthes y otros estudiaron a 90 pacientes en 2010 utilizando Escherichia coli Nissile 1917 en forma de enema durante al menos 2 semanas [15].
A los pacientes se les hizo una prueba del índice de actividad de la enfermedad UC después para determinar si la enfermedad mostraba o no remisión. Se observó tolerancia en 80 pacientes, lo que demuestra que esto puede ser una alternativa eficiente para los tratamientos de la Colitis Ulcerosa.
En 2010, Tursi y otros estudiaron los efectos del VSL#3, una mezcla de 4 cepas de Lactobacilli, 3 cepas de Bifidobacteria y una cepa de Streptococcus thermophilus en 144 pacientes con CU [16]. 71 pacientes en el grupo de control recibieron 2 sobres que contenían las bacterias mencionadas anteriormente (VSL # 3) dos veces al día durante un período de 8 semanas.
Después del tratamiento, se les preguntó a los pacientes sobre la remisión clínica utilizando el índice de actividad de la enfermedad de UC. Hubo una disminución en la actividad de la enfermedad en aquellos pacientes tratados con VSL en comparación con el grupo placebo ( p = 0.010).
Los investigadores también notaron que VSL # 3 redujo el sangrado rectal y redujo significativamente los puntajes UCDAI en comparación con el placebo. La eficacia de VSL # 3 también se probó en pacientes con EC en 2015 por un estudio realizado por Fedorak [ 17].] Este estudio incluyó a 120 participantes que recibieron 1 paquete de VSL # 3 diariamente durante 3 meses.
Posteriormente, los pacientes se sometieron a pruebas endoscópicas para registrar cualquier cambio en la mucosa del colon. Los médicos no registraron ningún cambio en la endoscopia entre el grupo control y el grupo placebo; sin embargo, el grupo de control tenía niveles más bajos de citocinas inflamatorias en la mucosa y una tasa más baja de recurrencia en comparación con el grupo placebo.
Esto sugiere que se necesita más investigación sobre los posibles efectos de VSL # 3 en la remisión de la enfermedad de Crohn.
Marteau y col. estudió los efectos de Lactobacillus johnsonii en 98 pacientes con EC sometidos a resección intestinal reciente [ 18 ]. El grupo de control recibió 1 paquete (2 × 10 9 ufc por paquete) de Lactobacillus johnsoniibacterias diariamente durante 6 meses, después de lo cual, los pacientes fueron examinados endoscópicamente para la recurrencia. El estudio concluyó que no había un efecto suficiente sobre la recurrencia de la EC.
Estos estudios demuestran que existe una relación entre las especies bacterianas en los probióticos y la enfermedad de la EII, como se ve en la Tabla 1 . Sin embargo, no hay suficientes datos para concluir si esta interacción es beneficiosa o no y, en caso afirmativo, en qué medida.
Sin embargo, los estudios han demostrado la relación entre los probióticos y los sistemas inmunes de la mucosa. Esta relación está mediada por receptores tipo Toll para promover la diferenciación de las células T-helper 1, aumentando así la producción de anticuerpos y la actividad fagocítica y de las células asesinas naturales, lo que conduce a la apoptosis inducida de las células T y a la regulación de las citocinas antiinflamatorias, reduciendo así la inflamación. en el intestino, que alivió los síntomas de la EII [ 17 ].
Tabla 1: Efectividad de los probióticos en la Enfermedad Inflamatorial Intestinal
Sin embargo, los estudios han demostrado que existe alguna diferencia entre varios grupos de población y pacientes con EII, lo que sugiere que si hubiera algunos tratamientos médicos favorables, tendrían que ser individuales para las necesidades de cada paciente en lugar de una opción de terapia general.
El impacto de los polifenoles en el origen de la EII
Los polifenoles son nutrientes naturales que se encuentran en sustancias de origen vegetal. Se encuentran principalmente en frutas, verduras, cereales, café y vino tinto [20].
Actúan como antioxidantes, preservando las células y los químicos del cuerpo contra cualquier daño que puedan causar los radicales libres, átomos reactivos que pueden dañar los tejidos del cuerpo.
Se consideran un método de protección para el cuerpo. Se sabe que los polifenoles son el antioxidante más abundante en la dieta humana, se consumen «10 veces más que la vitamina C y 100 veces más que la vitamina E y los carotenoides» [ 21 ].
Los polifenoles se ingieren en un promedio de 900 mg / día [22]. La mayoría de las pruebas vigorosas y los estudios de beneficios para la salud no comenzaron hasta mediados de la década de 1990; Sin embargo, ha despertado el interés de muchos científicos la busqueda de posibles roles protectores en los polifenoles.
Se especula que esto se debe a su gran variedad y estructura. Sin embargo, un estudio realizado en 2017 investigó los efectos de los polifenoles en la salud de ratones con EII. Scarano y col. Estudió específicamente los efectos de los flavanoles, estilbenoides y antocianinas en ratones y su efecto sobre los procesos inflamatorios observados en la EII [23].
Los trastornos de la EII se caracterizan por una respuesta excesiva e incontrolada del sistema inmune en la mucosa intestinal contra la microflora natural del cuerpo. Los polifenoles se han estudiado como método preventivo en pacientes con EII mediante la modulación de la flora intestinal [24].
Esto se debe en parte a los efectos antioxidantes de los polifenoles, pero también a sus efectos antienvejecimiento, antiapoptóticos y antiinflamatorios.
Estos efectos antiinflamatorios también se encontraron en estudios in vitro. «La mayoría de los polifenoles tenían un comportamiento antiinflamatorio al inhibir la activación de la cascada de NF-kB en, al menos, uno de los siguientes pasos: inhibidor de la actividad enzimática de la NF-kB quinasa (IKK) que controla el inhibidor de la fosforilación de kB (IkB) , Fosforilación / degradación de IkB asociada con la liberación activa de NF-kB y la actividad transcripcional de NF-kB en sí misma ”[ 24 ]. La vía NF-kB tiene muchas funciones importantes, pero principalmente desempeña un papel vital en las respuestas inflamatorias a nivel celular.
Se han realizado algunos estudios para estudiar los efectos de los estándares de polifenoles puros sobre la inflamación intestinal, tanto en estudios in vivo como in vitro.
Es importante señalar que muchos de los efectos positivos de los polifenoles se observan en niveles mucho más altos que aquellos a los que los humanos están expuestos naturalmente a través de la dieta.
No obstante, si la investigación continua demuestra ser tan eficiente como lo que se ha visto hasta la fecha, el aumento de la ingesta de polifenoles podría usarse como un tratamiento exitoso en la EC y la CU.
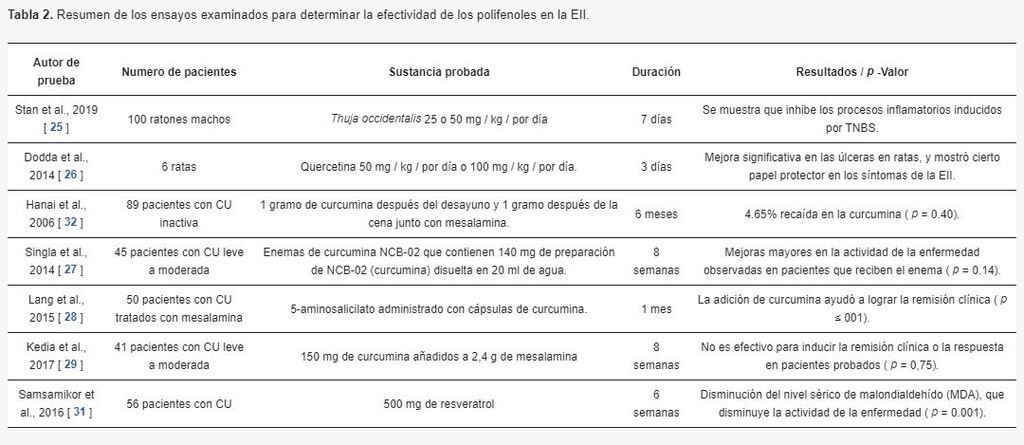
Un estudio publicado en 2019 ha observado propiedades terapéuticas de Thuja occidentalis cuando se administra en dosis medias a altas, que se demostró que inhibe el proceso inflamatorio inducido por TNBS (ácido trinitrobencenosulfónico) en el intestino [25].
Los científicos que realizaron este estudio concluyeron que la explicación más probable es la gran cantidad de flavonoides y compuestos fenólicos que se encuentran en la sustancia. En 2014 se realizó un estudio en ratas, probando la efectividad de la quercetina en ratas con síntomas similares a la EII inducidos por ácido acético.
La quercetina, un flavanol que se encuentra en muchas frutas y verduras, es el polifenol más estudiado en la inflamación intestinal [24].
Dodda, Chhajed y Mishra notaron que hubo una mejoría significativa en las úlceras en las ratas, y concluyeron que la quercetina ha demostrado proporcionar un papel protector en los síntomas similares a la EII. El mecanismo detrás de esta respuesta positiva es que la quercetina afecta el estrés oxidativo que permite la reversión de la respuesta inflamatoria local y, a su vez, causa la curación de la lesión hemorrágica [ 26]
La curcumina, un compuesto derivado del rizoma de Curcuma longa es un tipo de curcuminoide. Es responsable de la coloración amarillenta de muchos platos y es ampliamente estudiado por sus efectos antiinflamatorios, en este caso, estudiado por su posible uso en pacientes con EII.
Hanai et al., Estudiaron 89 pacientes con CU inactiva. Cuarenta y cinco pacientes recibieron 1 gramo de curcumina después del desayuno y 1 gramo después de la cena junto con mesalamina, y otros 44 pacientes recibieron placebo con mesalamina o sulfasalazina. Los resultados principales mostraron que el 4.65% recayó en la curcumina, mientras que el 20.51% recayó en el grupo placebo [27].
En 2014, Singla et al. estudió los efectos de los enemas de curcumina y los enemas de placebo en 45 pacientes con CU distal leve a moderada. Hubo una mejoría mayor en la actividad de la enfermedad observada en pacientes con enema de curcumina [ 27 ].
Lang y col. observó los efectos de 5 ASA (5-aminosalicilato) administrados con cápsulas de curcumina (3 g / día) o placebo con 5 ASA. El 54% de los pacientes que recibieron curcumina alcanzaron la remisión clínica, a diferencia de los del grupo placebo [28].
Por último, Kedia et al. estudió a 41 pacientes con una dosis baja de curcumina (150 mg) durante 8 semanas añadida a mesalamina. Esto no fue eficaz para inducir la remisión clínica o la respuesta en pacientes, lo que sugiere que podría ser necesaria una dosis más alta [29].
El resveratrol es otro polifenol natural conocido. Se detecta en muchas plantas y se puede encontrar en la piel de las uvas, los arándanos y en los cacahuetes o maní. Muchos estudios han demostrado que el resveratrol tiene un alto potencial antioxidante y antiinflamatorio [30].
Samsamikor y col. estudió 56 pacientes y los efectos del resveratrol en la CU. Parte de este grupo recibió 500 mg de resveratrol por día, mientras que el otro recibió una dosis de placebo. El grupo que recibió resveratrol mostró una disminución del nivel sérico de malondialdehído (MDA) que se correlaciona con niveles más bajos de estrés oxidativo y una disminución significativa de la actividad de la enfermedad con una mejor calidad de vida ( p ≤ 0.001) [31].
Los estudios resumidos en la Tabla 2 han mostrado algún vínculo entre los polifenoles y la Colitis Ulcerosa / Enfermedad de Crohn.
Existe abundante evidencia que sugiere que se necesita más investigación sobre el uso de polifenoles, específicamente quercetina, en el tratamiento de algunos síntomas de la EII, así como sus posibles funciones protectoras para la microbiota intestinal. La curcumina y el resveratrol también han mostrado algunos resultados prometedores que pueden ser beneficiosos para los pacientes que padecen EII al disminuir la actividad de la enfermedad y lograr la remisión clínica.
El impacto de la fibra en el origen de la EII
El destino de los pacientes con EII es algo problemático ya que no hay cura para la enfermedad hasta la fecha. Las opciones terapéuticas han mostrado cierto éxito en entornos clínicos y han inducido la remisión de la enfermedad; Sin embargo, no es un tratamiento curativo.
Por lo tanto, la investigación de nuevos métodos es necesaria para encontrar otras formas efectivas de aliviar los síntomas en estos pacientes.
La fibra es una de estas sustancias que ha despertado un interés reciente dentro de la comunidad científica, con la hipótesis de que el efecto puede deberse a interacciones directas con la mucosa intestinal o indirectamente a través del microbioma [33].
La Comisión del Codex Alimentarius ha definido las fibras como «polímeros de carbohidratos con diez o más unidades monoméricas, que no son hidrolizadas por las enzimas endógenas en el intestino delgado de los humanos y pertenecen a categorías posteriores» [34].
La influencia de las fibras en la etiología de la EC y la CU es poco conocida. Se pueden recomendar dietas bajas en residuos en aquellos pacientes con formas activas de enfermedad, pero en pacientes inactivos, la fibra dietética rara vez se considera debido a las diferencias individuales en las tolerancias dietéticas [35].
Los efectos sobre la salud varían entre los distintos tipos de fibras, pero pueden incluir la reducción de la diarrea / estreñimiento, la producción de ácidos grasos de cadena corta, la regulación de la inflamación y la cicatrización de los tejidos.
Todos estos efectos juegan un papel en la prevención del inicio del cáncer colorrectal en pacientes con EII susceptibles [36]. La colonoscopia y la gastroscopia han demostrado ser las herramientas más eficientes para evaluar el alcance de la enfermedad y su actividad en la EII [37].
Junto con estos métodos de imágenes, los médicos han utilizado escalas y puntajes análogos visuales, como el CDAI (índice de actividad de la enfermedad de Crohn) y el índice Harvey-Bradshaw, para evaluar la efectividad de la terapia. Los biomarcadores, como la PCR, la VSG del suero, la calprotectina fecal y la IL-10 también se utilizan para determinar el alcance de los cambios [38 ,39].
Se han estudiado muchos tipos de fibras, como:
por sus efectos en pacientes con EII.
Fructanos
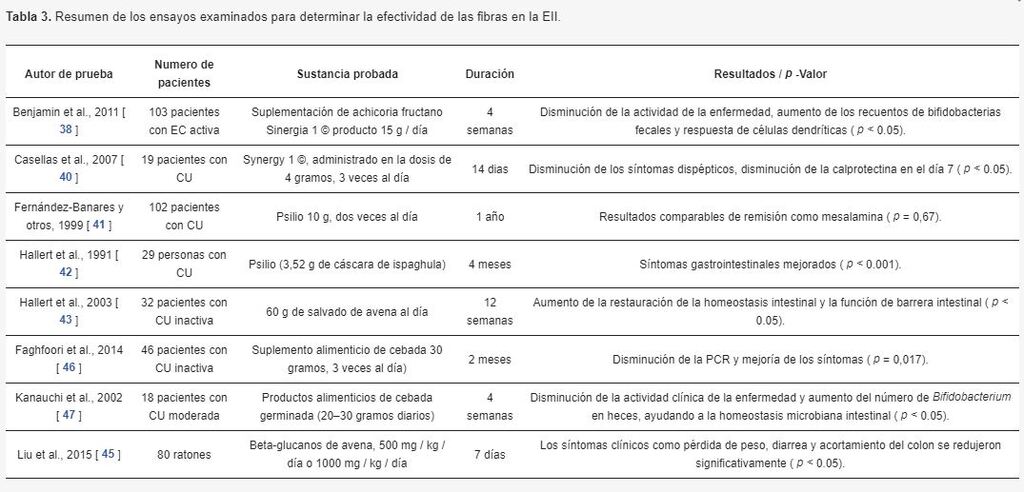
Se compararon varios estudios que investigaron los efectos de los fructanos. Un estudio realizado en 2011 incluyó la suplementación de fructosa de achicoria como producto Synergy 1 © 15 g / día en un ensayo controlado aleatorio, doble ciego durante 4 semanas para pacientes con Enfermedad de Crohn activa.
Hubo 103 pacientes en total, 54 de los cuales recibieron suplementos de fructanos, mientras que el resto recibió un placebo con maltodextrina.
Los resultados de este estudio con suplementación de fructanos mostraron una disminución de la actividad de la enfermedad de Crohn,
un aumento de los recuentos de bifidobacterias fecales, así como una respuesta de células dendríticas [38].
Las mediciones de estos resultados se obtuvieron a través de varios métodos, como la escala CDAI, PCR sérica, VSG y mediciones de calprotectina fecal.
El siguiente estudio realizado en 19 pacientes con CU, también usando fructano en Synergy 1 ©, administrado en la dosis de 4 gramos, 3 veces al día durante 14 días en un ensayo piloto de control aleatorio. De estos 19 pacientes, 9 recibieron medicamentos placebo. Se observaron los siguientes resultados: una disminución de los síntomas dispépticos y una disminución de la calprotectina en el día 7, lo que indica una mejoría en la actividad de la enfermedad [40].
En resumen, los estudios realizados hasta la fecha implican que la adición de fructanos a la dieta puede aliviar los síntomas gastrointestinales, así como aumentar la función inmune intestinal, reducir la inflamación y modular positivamente la microbiota gastrointestinal.
Suplemento de Psyllium
El psyllium ha mostrado algún beneficio en la mejora de los síntomas gastrointestinales en un estudio realizado por Fernández-Banares et al. en 1999. El grupo de estudio compuesto por 102 individuos, 35 de los cuales recibieron solo psyllium, 37 recibieron solo mesalamina y los 30 restantes recibieron ambos métodos de tratamiento [41].
Después de un año, estos pacientes fueron reevaluados, y los hallazgos sugirieron que el psyllium podría tener efectos de remisión comparables a la mesalamina.
La mesalamina se usa comúnmente para tratar pacientes con EII al reducir la producción de prostaglandinas, lo que disminuye la inflamación en el colon y los síntomas asociados con la CU.
Hallert y col. encontró resultados similares en un estudio realizado en 1991, concluyendo que
el psyllium ha mejorado los síntomas gastrointestinales, como dolor abdominal, diarrea, hinchazón, evacuación incompleta y estreñimiento en pacientes de colitis ulcerosa (CU).
Este grupo de estudio estaba compuesto por 29 personas, de las cuales 16 fueron tratadas con psyllium, las otras recibieron un placebo con pan crujiente [42].
Suplemento de salvado de avena
Hallert y col. realizó un estudio en 2003 en 32 pacientes con Colitis Ulcerosa inactiva que recibieron 60 g de salvado de avena diariamente durante 12 semanas.
Los investigadores observaron un aumento del 30% del butirato en las heces en la semana 4, lo que implica una mayor restauración de la homeostasis intestinal y la función de la barrera intestinal [43,44].
Otro ensayo de Bo Liu et al. en 2015 estudió los efectos de los beta-glucanos de avena (βG) que están presentes en altas concentraciones en el salvado de avena.
El estudio se realizó en 80 ratones, en los cuales 60 ratones tenían colitis inducida con sulfato sódico de dextrano (DSS). Veinte ratones no fueron inducidos con DSS, siendo estos, el grupo de control. Los siguientes 20 recibieron solo DSS. El tercer grupo de 20 ratones recibió DSS y una dosis baja de βG (500 mg / kg) y los 20 restantes recibieron DSS y una dosis alta de βG (1000 mg / kg) [45].
Los hallazgos observados mostraron que los síntomas clínicos, como una menor pérdida de peso, diarrea y acortamiento del colon, se redujeron significativamente en los ratones que recibieron βG.
Suplemento de Cebada
Un estudio realizado en 2014 por Faghfoori probó los efectos de la suplementación con alimentos de cebada en pacientes con CU inactiva a través de un estudio de grupo de control aleatorizado con una duración de 2 meses.
Esta suplementación con cebada resultó en una disminución del nivel medio de CRP en el suero, y en mejoras de los síntomas, como la reducción del dolor y los calambres abdominales [46].
En 2002, Kanauchi y otros estudiaron los efectos del alimento de cebada germinada y observaron una disminución de las puntuaciones del índice de actividad clínica y un aumento de las concentraciones de Bifidobacterium en las heces que, según se ha comprobado, contribuyen a la homeostasis de los microbios intestinales [47]. Este estudio se llevó a cabo en 18 pacientes, 11 de los cuales recibieron el medicamento.
Las fibras mencionadas anteriormente que se ven en la Tabla 3 han mostrado un efecto positivo sobre los síntomas de los pacientes con EII.
Sustancias como fructanos, psyllium, salvado de avena y cebada disminuyeron los síntomas gastrointestinales en los pacientes, aliviando las molestias y mejorando su calidad de vida.
Los resultados de estos estudios también han demostrado una disminución en la actividad de la enfermedad y su progresión.
Es necesaria una investigación continua para llegar a un consenso sobre la dosificación ideal de estas sustancias para lograr resultados óptimos y potencialmente considerar esta adición a las pautas de tratamiento en el futuro.
Tabla 3. Resumen de los ensayos examinados para determinar la efectividad de las fibras en la EII.
El impacto de los ácidos grasos en el origen de la EII
Los ácidos grasos Omega 3 y Omega 6 son sustancias muy importantes en la dieta humana; Sin embargo, parece haber cierta discrepancia entre su consumo.
El ácido linoleico (omega 6) se ha consumido en mayores cantidades desde el siglo pasado, lo que se ha relacionado con un aumento en la prevalencia de EC y CU.
Por otro lado, se consideran útiles mayores cantidades de omega 3 [ácido docosahexaenoico (DHA) y ácido eicosapentaenoico (EPA)]. Han demostrado reemplazar el ácido araquidónico e inhibir la producción de mediadores proinflamatorios, siendo indispensables para resolver los procesos de inflamación.
Estos ácidos están directamente relacionados con la mejora de los niveles de lípidos en la sangre y la atenuación de los procesos de inflamación que se observan en las enfermedades inflamatorias.
Las acciones antiinflamatorias pueden estar asociadas con su capacidad o cambiar la composición de la membrana celular, lo que a su vez, alivia los síntomas y el malestar relacionados con la EII [48].
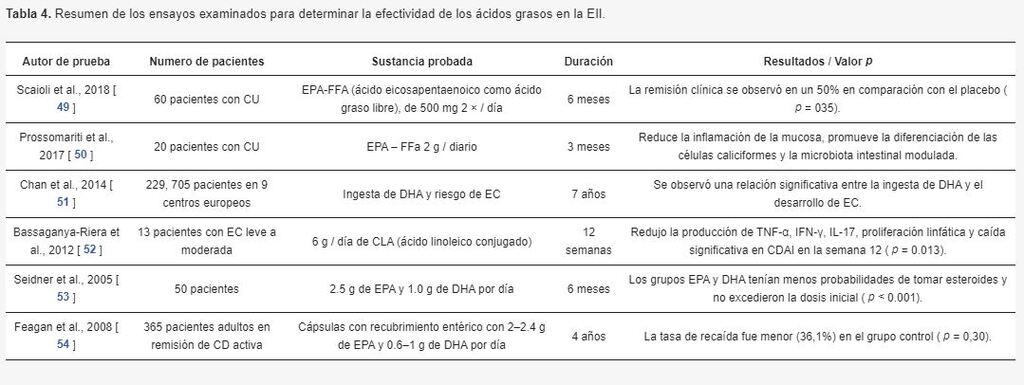
En 2018, Scaioli et al., Se realizó un estudio como un ensayo controlado aleatorio, en el que participaron 60 pacientes con CU mayores de 18 años. Los pacientes sometidos a este estudio tuvieron un puntaje de Mayo / Índice de actividad de la enfermedad (DAI) de más de 2 y calprotectina fecal por encima / igual a 150 μg / g.
Estuvieron en terapia continua durante 3 meses o más. Este ensayo controlado aleatorio dividió a los pacientes en dos grupos: uno con EPA-FFA (ácido eicosapentaenoico como ácido graso libre) de 500 mg 2x / día y el otro placebo con una duración de 6 meses.
La remisión clínica se observó a los 6 meses después de comenzar la terapia en el 76% del grupo EPA-FFA en comparación con el 50% en el grupo placebo (p = 035). Los niveles de calprotectina también se redujeron significativamente (63% en el grupo tratado, p <001) [49].
Prossomariti y col. probó la misma suplementación y tuvo resultados similares [50]. Un estudio de cohorte publicado en 2014 informó una relación significativa entre la ingesta de DHA y el desarrollo de EC.
Chan y col. informó una disminución en los nuevos casos de EC, equivalente a 4 individuos / 100,000 habitantes / año, exhibiendo una correlación positiva [51].
Un ensayo doble ciego, controlado con placebo, aleatorizado realizado por Bassaganya-Riera et al. demostró que el uso de 6 gramos / día durante 12 semanas de CLA (ácido linoleico conjugado) redujo la producción de TNF-α, IFN-γ, IL-17, proliferación linfática y una caída significativa en CDAI en la semana 12 ( p = 0.013) [ 52].
Estas reducciones sugieren la baja regulación de las citocinas proinflamatorias que conducen a una puntuación más baja de CDAI y progresan hacia la remisión.
En 2005, Seidner et al., Realizaron un estudio doble ciego controlado con placebo en 86 pacientes con CU leve a moderada. Los pacientes se dividieron en un grupo de control (50 pacientes) que recibió un suplemento líquido basado en sacarosa y el grupo de sustancia activa (36 pacientes) que recibió 2,5 g de EPA y 1,0 g de DHA por día durante 6 meses. Como ambos grupos sufrían de CU activa, también estaban tomando corticosteroides sintomáticamente.
El estudio no produjo diferencias significativas entre ambos grupos; sin embargo, el grupo que recibió EPA y DHA fue menos propenso a tomar esteroides, y no excedió la dosis inicial durante el estudio ( p <0.001) [ 53].
Un estudio realizado por Feagan et al., En 2008, probó a 365 pacientes adultos en remisión de EC inactiva, tratándolos con cápsulas con recubrimiento entérico con 2–2.4 g de EPA y 0.6-1 g de DHA por día.
El grupo placebo recibió MCT (aceite de triglicéridos de cadena media). A los pacientes no se les permitió usar ningún otro medicamento. Los resultados mostraron que la tasa de recaída fue menor (tasa de recaída del 36,1%) que el grupo placebo (tasa de recaída del 35,7%) ( p = 0,30) [54].
En general, los ácidos grasos en cuestión (EPA y DHA), enumerados en la Tabla 4 , han demostrado estar asociados con la remisión clínica y la disminución de la actividad de la enfermedad.
Han demostrado ayudar a reducir el uso de corticosteroides durante toda la enfermedad, lo que tiene beneficios a largo plazo.
El uso de suplementos de ácidos grasos en la dieta podría ser un tratamiento complementario efectivo para las terapias actuales.
Si bien es necesario realizar más estudios para evaluar la dosis más efectiva y la efectividad a largo plazo, los estudios sugieren una alternativa o aditivo potencial, viable a la medicación actual.
Tabla 4. Resumen de los ensayos examinados para determinar la efectividad de los ácidos grasos en la EII.
El impacto de la dieta baja en FODMAP en el origen de la EII
A medida que la EII se ha convertido en un problema más frecuente en el mundo occidental, muchos científicos han estado estudiando varias dietas para encontrar una manera de facilitar el estilo de vida del paciente y la progresión de la enfermedad.
Los médicos de todo el mundo han desaconsejado muchas sustancias, como el café, los alimentos picantes, los alcoholes, ya que se ha observado que empeoran la condición del paciente y disminuyen la comodidad.
Dicho esto, hay algunas sustancias que han mejorado la calidad de vida de los pacientes con EII al reducir sus síntomas similares a los del SII. Se estima que más del 30% de los pacientes con EII tienen SII concomitante y que los síntomas gastrointestinales funcionales se observan aproximadamente 3 veces más frecuentemente en pacientes con EII en comparación con la población general [55,56].
Se han elaborado dietas específicas y se pueden recomendar a estos pacientes, incluidas las sustancias beneficiosas. Dicha dieta popular se conoce como una dieta baja en Fermentables Oligo, Di, Monosacárido y Polioles (dieta baja en FODMAP).
La dieta baja en FODMAP es una restricción dietética de oligosacáridos fermentables, disacáridos, monosacáridos y polioles, denominados «FODMAP».
Estos son carbohidratos de cadena corta, altamente fermentables y de baja absorción que conducen a disbiosis intestinal, lesiones / inflamación, exceso de formación de gases y distensión luminal a través de la fermentación bacteriana y secreción de agua [57].
Se recomiendan los siguientes alimentos cuando se sigue una dieta baja en FODMAP: carne, aves, pescado, huevos, lácteos sin lactosa, granos sin gluten (es decir, arroz), fruta (es decir, plátanos), verduras (es decir, espinacas), la mayoría de los frutos secos, la mayoría de las especias y las hierbas.
Evitar los alimentos con alto contenido en lactosa, las legumbres, el ajo y la cebolla.
Se recomienda a los pacientes que sigan estrictas restricciones dietéticas durante las primeras 4 a 6 semanas antes de introducir algunos FODMAP y que vigilen de cerca cualquier cambio en los síntomas para llegar a un nivel óptimo de restricciones de FODMAP que se adapte mejor a sus necesidades individuales [58].
Un estudio publicado en 2017 por Pederson et al. estudió los efectos de una dieta baja en FODMAP en 78 pacientes adultos con EII y síntomas similares al SII. Después de 6 semanas, el grupo de la dieta baja FODMAP mostró una reducción significativa de los síntomas del SII (Síndrome del Intestino Irritable) y una puntuación más alta en un cuestionario sobre su calidad de vida (p < 0,01) [59].
Cox y otros, realizaron otro estudio en 2017 en 32 pacientes con EII que también tenían síntomas gastrointestinales funcionales, hinchazón funcional o diarrea funcional. Los pacientes fueron divididos al azar en grupos que recibían un carbohidrato (fructano, galacto-oligosacáridos (GOS) o sorbitol) o el grupo de placebo que recibía glucosa.
Los participantes tuvieron que beber una bebida de desafío una vez al día durante 3 días seguidos de un período de «lavado» que duró 4 días como mínimo. Luego se les exigiría que bebieran una de las otras sustancias del mismo protocolo hasta que se consumieran todas las sustancias.
Se registraron los síntomas gastrointestinales y la producción de heces antes de que se iniciara cada reto y justo después de que se completara. Una vez que se completaron las cuatro pruebas y el período de lavado final, se analizaron los síntomas observados y estos son los resultados: menos pacientes informaron de una mejoría de los síntomas gastrointestinales (62,1%), en comparación con el grupo que consumía glucosa (89,7%) (p = 0,033). También hubo una mayor gravedad del dolor (p = 0,004), hinchazón (p = 0,002), flatulencia (p = 0,004) y urgencia fecal (p = 0,014) en el último día de la prueba de fructosa en comparación con la glucosa [60].
De manera similar, Prince y otros encontraron un aumento significativo en el número de pacientes que informaron de un alivio satisfactorio de los síntomas con la aplicación de una dieta baja en FODMAP. (p < 0.001) [61].
La evidencia con respecto a la efectividad de una dieta baja en FODMAP es convincente, y muestra una correlación positiva entre la baja FODMAP y la reducción de los síntomas y molestias gastrointestinales clínicas
como se puede ver en la Tabla 5. Esto, por supuesto, conducirá a una mayor calidad de vida. También es importante tener en cuenta que a medida que disminuyen los casos de inflamación y lesión intestinal, los efectos a largo plazo son menos dramáticos y alteran la vida.
Aunque los estudios muestran un efecto positivo, también concluyen que esta dieta es muy específica para cada individuo, ya que cada paciente puede tolerar diferentes cantidades de FODMAP y, por lo tanto, tener un alivio diferente de los síntomas.
La orientación de un dietista clínico demostraría ser beneficiosa y ayudaría a los pacientes a alcanzar un nivel óptimo que se ajuste mejor a sus necesidades diarias.
Tabla 5. Resumen de ensayos examinados para determinar la efectividad de la dieta baja en FODMAP en la EII.

Conflictos de interés
Los autores declaran no tener ningún conflicto de intereses.
Referencias
- Centros de Control y Prevención de Enfermedades. Disponible en línea: https://www.cdc.gov/features/inflammatory-bowel-disease/index.html (consultado el 16 de noviembre de 2019).
- Organización Mundial de Gastroenterología. Disponible en línea: https://www.worldgastroenterology.org/guidelines/global-guidelines/inflammatory-bowel-disease-ibd/inflammatory-bowel-disease-ibd-english (consultado el 16 de noviembre de 2019).
- Fundación de Investigación de Enfermedades Intestinales. Disponible en línea: https://bdrf.org.uk/bowel-disease/ibd/ (consultado el 16 de noviembre de 2019).
- Yu, YR; Rodríguez, JR Presentación clínica de la enfermedad de Crohn, colitis ulcerosa y colitis indeterminada: síntomas, manifestaciones extraintestinales y fenotipos de enfermedades. Semin Pediatr Surg. 2017 , 2 , 349–355. [ Google Académico ] [ CrossRef ]
- Flynn, S .; Eisenstein, S. Inflamatorry Enfermedad intestinal Presentación y diagnóstico. Surg. Clin. N. Am. 2019 , 99 , 1051-1062. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Singh, S .; Chowdhry, M .; Umar, S .; Bilal, M .; Clarke, K. Variaciones en el tratamiento médico de la enfermedad inflamatoria intestinal entre gastroenterólogos. Gastroenterol Rep. De 2017 , 6 , 61–64. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Langhorst, J .; Elsenbruch, S .; Koelzer, J .; Rueffer, A .; Michalsen, A .; Dobos, GJ Marcadores no invasivos en la evaluación de la inflamación intestinal en enfermedades inflamatorias del intestino: rendimiento de lactoferrina fecal, calprotectina y PMN-elastasa, PCR e índices clínicos. A.m. J. Gastroenterol. 2008 , 103 , 162–169. [ Google Académico ] [ CrossRef ]
- Knight-Sepulveda, K .; Kais, S .; Santaolalla, R .; Abreu, Dieta MT y Enfermedad Inflamatoria Intestinal. Gastroenterol Hepatol. 2015 , 11 , 511–520. [ Google Académico ]
- Peterson, DA; Frank, DN; Pace, NR; Gordon, JI Enfoques metagenómicos para definir la patogenia de las enfermedades inflamatorias del intestino. Cell Host Microbe 2008 , 3 , 417–427. [ Google Académico ] [ CrossRef ]
- Lupp, C .; Robertson, ML; Wickham, M .; Sekirov, I .; Campeón, OL; Gaynor, CE; Finlay, la inflamación mediada por el huésped BB interrumpe la microbiota intestinal y promueve el crecimiento excesivo de enterobacterias. Cell Host Microbe 2007 , 2 , 119–129. [ Google Académico ] [ CrossRef ]
- Kurakawa, T .; Ogata, K .; Matsuda, K .; Tsuji, H .; Kubota, H .; Takada, T .; Kado, Y .; Asahara, T .; Takahashi, T .; Nomoto, K. Diversidad del grupo de Clostridium coccoides intestinal en la población japonesa, como lo demuestra la transcripción inversa-PCR cuantitativa. PLoS ONE 2015 , 10 , e0126226. [ Google Académico ] [ CrossRef ]
- Wang, W .; Chen, L .; Zhou, R .; Wang, X .; Song, L .; Huang, S .; Wang, G .; Xia, B .; Forbes, BA aumentó las proporciones de Bifidobacterium y el grupo Lactobacillus y la pérdida de bacterias productoras de butirato en la enfermedad inflamatoria intestinal. J. Clin. Microbiol 2013 , 52 , 398–406. [ Google Académico ] [ CrossRef ]
- Dalmasso, JDG; Delmas, GDARBJ Escherichia coli: Lo bueno, lo malo y lo feo. Clin. Microbiol Acceso abierto 2015 , 4 , 1–3. [ Google Académico ] [ CrossRef ]
- Dore, MP; Rocchi, C .; Longo, NP; Scanu, AM; Vidili, G .; Padedda, F .; Pes, efecto GM del uso de probióticos en eventos adversos en pacientes adultos con enfermedad inflamatoria intestinal: un estudio de cohorte retrospectivo. Probióticos Antimicrobianos. Proteínas 2019 , 12 , 152-159. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Tursi, A .; Brandimarte, G .; Papa, A .; Giglio, A .; Elisei, W .; Giorgetti, GM; Forti, G .; Morini, S .; Hassan, C .; Pistoia, MA; et al. Tratamiento de la colitis ulcerosa leve a moderada recurrente con el VSL probiótico n. ° 3 como complemento de un tratamiento farmacéutico estándar: un estudio doble ciego, aleatorizado, controlado con placebo. A.m. J. Gastroenterol. 2010 , 105 , 2218–2227. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Fedorak, R .; Feagan, BG; Hotte, N .; Leddin, D .; Dieleman, LA; Petrunia, DM; Enns, R .; Bitton, A .; Chiba, N .; Paré, P .; et al. El probiótico VSL # 3 tiene efectos antiinflamatorios y podría reducir la recurrencia endoscópica después de la cirugía para la enfermedad de Crohn. Clin. Gastroenterol Hepatol. 2015 , 13 , 928–935.e2. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Abraham, B .; Quigley, EM Probióticos en la enfermedad inflamatoria intestinal. Gastroenterol Clin. N. Am. 2017 , 46 , 769–782. [ Google Académico ] [ CrossRef ]
- Marteau, P .; Lemann, M .; Seksik, P .; Laharie, D .; Colombel, JF; Bouhnik, Y .; Cadiot, G .; Soule, JC; Bourreille, A .; Metman, E .; et al. Ineficacia de Lactobacillus johnsonii LA1 para la profilaxis de la recurrencia postoperatoria en la enfermedad de Crohn: un ensayo aleatorizado, doble ciego, controlado con placebo GETAID. Gut 2006 , 55 , 842–847. [ Google Académico ] [ CrossRef ]
- Matthes, H .; Krummenerl, T .; Giensch, M .; Wolff, C .; Schulze, J. Ensayo clínico: tratamiento probiótico de colitis ulcerosa distal aguda con Escherichia coli Nissle 1917 administrada por vía rectal (EcN). Complemento BMC. Altern Medicina. 2010 , 10 , 13. [ Google Scholar ] [ CrossRef ]
- Cardona, F .; Andres-Lacueva, C .; Tulipani, S .; Tinahones, FJ; Queipo-Ortuño, MI Beneficios de los polifenoles en la microbiota intestinal e implicaciones en la salud humana. J. Nutr. Biochem. 2013 , 24 , 1415–1422. [ Google Académico ] [ CrossRef ]
- Scalbert, A .; Johnson, I .; Saltmarsh, M. Polyphenols: Antioxidants y más allá. A.m. J. Clin. Nutr. 2005 , 81 , 215S – 217S. [ Google Académico ] [ CrossRef ]
- Del Bo ‘, C .; Bernardi, S .; Marino, M .; Porrini, M .; Tucci, M .; Guglielmetti, S .; Cherubini, A .; Carrieri, B .; Kirkup, B .; Kroon, PA; et al. Revisión sistemática sobre la ingesta de polifenoles y los resultados de salud: ¿hay evidencia suficiente para definir un patrón dietético rico en polifenoles que promueva la salud? Nutrients 2019 , 11 , 1355. [ Google Scholar ] [ CrossRef ]
- Scarano, A .; Butelli, E .; De Santis, S .; Cavalcanti, E .; Hill, L .; De Angelis, M .; Giovinazzo, G .; Chieppa, M .; Martin, C .; Santino, A. Las antocianinas, flavonoles y estilbenoides dietéticos combinados alivian los síntomas de la enfermedad inflamatoria intestinal en ratones. Frente. Nutr. 2018 , 4 , 1–10. [ Google Académico ] [ CrossRef ]
- Romier, B .; Schneider, Y.-J .; Larondelle, Y .; Durante, A. Los polifenoles dietéticos pueden modular la respuesta inflamatoria intestinal. Nutr. Rev. 2009 , 67 , 363–378. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Stan, M .; Voicu, SNP; Caruntu, S .; Nica, IC; Olah, N .; Burtescu, R .; Balta, C .; Rosu, M .; Herman, H .; Hermenean, A .; et al. Propiedades antioxidantes y antiinflamatorias de una tintura madre de Thuja occidentalis para el tratamiento de la colitis ulcerosa. Antioxidantes 2019 , 8 , 416. [ Google Scholar ] [ CrossRef ]
- Dodda, D .; Chhajed, R .; Mishra, J. Efecto protector de la quercetina contra la enfermedad inflamatoria intestinal (EII) inducida por ácido acético como síntomas en ratas: posibles alteraciones morfológicas y bioquímicas. Pharmacol Rep. 2014 , 66 , 169-173. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Singla, V .; Mouli, VP; Garg, SK; Rai, T .; Choudhury, BN; Verma, P .; Deb, R .; Tiwari, V .; Rohatgi, S .; Dhingra, R .; et al. Inducción con enema NCB-02 (curcumina) para la colitis ulcerosa distal leve a moderada: un estudio piloto aleatorizado, controlado con placebo. J. Crohns Colitis 2014 , 8 , 208–214. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Lang, A .; Salomon, N .; Wu, JC; Kopylov, U .; Lahat, A .; Har-Noy, O .; Ching, JY; Cheong, PK; Avidan, B .; Gamus, D .; et al. La curcumina en combinación con mesalamina induce la remisión en pacientes con colitis ulcerosa leve a moderada en un ensayo controlado aleatorio. Clin. Gastroenterol Hepatol. 2015 , 13 , 1444–1449.e1. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Kedia, S .; Bhatia, V .; Thareja, S .; Garg, S .; Mouli, VP; Bopanna, S .; Tiwari, V .; Makharia, G .; Ahuja, V. La dosis baja de curcumina oral no es efectiva en la inducción de la remisión en la colitis ulcerosa leve a moderada: resultados de un ensayo aleatorizado doble ciego controlado con placebo. Mundo J. Gastrointest. Pharmacol El r. 2017 , 8 , 147-154. [ Google Académico ] [ CrossRef ]
- Salehi, B .; Mishra, AP; Nigam, M .; Sener, B .; Kilic, M .; Sharifi-Rad, J .; Fokou, PVT; Martins, N .; Sharifi-Rad, J. Resveratrol: una espada de doble filo en beneficios para la salud. Biomedicines 2018 , 6 , 91. [ Google Scholar ] [ CrossRef ]
- Samsamikor, M .; Daryani, NE; Asl, PR; Hekmatdoost, A. Suplementación con resveratrol y estado oxidativo / antioxidante en pacientes con colitis ulcerosa: un estudio piloto aleatorizado, doble ciego, controlado con placebo. Arco. Medicina. Res. 2016 , 47 , 304-309. [ Google Académico ] [ CrossRef ]
- Hanai, H .; Iida, T .; Takeuchi, K .; Watanabe, F .; Maruyama, Y .; Andoh, A .; Tsujikawa, T .; Fujiyama, Y .; Mitsuyama, K .; Sata, M .; et al. Terapia de mantenimiento de la curcumina para la colitis ulcerosa: ensayo aleatorizado, multicéntrico, doble ciego, controlado con placebo. Clin. Gastroenterol Hepatol. 2006 , 4 , 1502-1506. [ Google Académico ] [ CrossRef ]
- Wong, C .; Harris, PJ; Ferguson, LR Beneficios potenciales de la intervención de fibra dietética en la enfermedad inflamatoria intestinal. En t. J. Mol. Sci. 2016 , 17 , 919. [ Google Scholar ] [ CrossRef ]
- Comisión Alimentarius. Directrices sobre el etiquetado nutricional CAC / GL 2-1985 como última modificación 2010 ; Programa Conjunto FAO / OMS sobre Normas Alimentarias; Secretaría de la Comisión del Codex Alimentarius, FAO: Roma, Italia, 2010. [ Google Scholar ]
- Triggs, CM; Munday, K .; Hu, R .; Fraser, AG; Gearry, RB; Barclay, ML; Ferguson, LR Factores dietéticos en la inflamación crónica: Tolerancias e intolerancias alimentarias de una población de la enfermedad de Crohn del Cáucaso de Nueva Zelanda. Mutat Res. Mol. Mech Mutageno. 2010 , 690 , 123–138. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Harris, PJ; Ferguson, LR Trigo y arroz en la prevención de enfermedades y la salud: beneficios, riesgos y mecanismos de los cereales integrales en la promoción de la salud ; Watson, R., Preedy, V., Zibadi, S., Eds .; Academic Press: Amsterdam, Países Bajos, 2014; pp. 201–210. [ Google Académico ]
- Basford, P .; Longcroft-Wheaton, G .; Bhandari, P. ASGE Technology Committee revisa la evaluación endoscópica en tiempo real de la histología de pólipos colorrectales diminutos y endoscopios de alta definición y gran aumento. Gastrointest. Endosc. 2015 , 82 , 1139–1140. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Benjamin, JL; Hedin, CR; Koutsoumpas, A .; Ng, SC; McCarthy, NE; Hart, AL; Kamm, MA; Sanderson, JD; Caballero, SC; Forbes, A .; et al. Ensayo aleatorizado, doble ciego, controlado con placebo de fructo-oligosacáridos en la enfermedad de Crohn activa. Gut 2011 , 60 , 923–929. [ Google Académico ] [ CrossRef ] [ PubMed ]
- De Preter, V .; Joossens, M .; Ballet, V .; Shkedy, Z .; Rutgeerts, P .; Vermeire, S .; Verbeke, K. Perfil metabólico del impacto de la inulina enriquecida con oligofructosa en pacientes con enfermedad de Crohn: un ensayo controlado aleatorio doble ciego. Clin. Transl. Gastroenterol 2013 , 4 , e30. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Casellas, F .; Borruel, N .; Torrejón, A .; Varela, E .; Antolin, M .; Guarner, F .; Malagelada, J.-R. La suplementación oral de inulina enriquecida con oligofructosa en la colitis ulcerosa aguda se tolera bien y se asocia con una disminución de la calprotectina fecal. Alimento. Pharmacol El r. 2007 , 25 , 1061-1067. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Fernández-Banares, F .; Hinojosa, J .; Sánchez-Lombrana, J .; Navarro, E .; Martinez-Salmeron, J .; García-Puges, A .; González-Huix, F .; Riera, J .; González-Lara, V .; Domínguez-Abascal, F .; et al. Ensayo clínico aleatorizado de semillas de plantago ovata (fibra dietética) en comparación con la mesalamina para mantener la remisión en la colitis ulcerosa. A.m. J. Gastroenterol. 1999 , 94 , 427–433. [ Google Académico ] [ CrossRef ]
- Hallert, C .; Kaldma, M .; Petersson, BG Ispaghula Husk puede aliviar los síntomas gastrointestinales en la colitis ulcerosa en remisión. Scand J. Gastroenterol. 1991 , 26 , 747–750. [ Google Académico ] [ CrossRef ]
- Hallert, C .; Björck, I .; Nyman, M .; Pousette, A .; Grännö, C .; Svensson, H. Aumento del butirato fecal en pacientes con colitis ulcerosa por dieta: estudio piloto controlado. Inflamm. Intestino dis. 2003 , 9 , 116–121. [ Google Académico ] [ CrossRef ]
- Venegas, DP; De La Fuente, MK; Landskron, G .; González, MJ; Quera, R .; Dijkstra, G .; Harmsen, HJM; Faber, KN; Hermoso, MA Ácidos grasos de cadena corta (AGCS): regulación epitelial e inmunológica intestinal mediada y su relevancia para las enfermedades inflamatorias del intestino. Frente. Immunol 2019 , 10 , 277. [ Google Scholar ] [ CrossRef ]
- Liu, B .; Lin, Q .; Yang, T .; Zeng, L .; Shi, L .; Chen, Y .; Luo, F. La avena β-glucano mejora la colitis ulcerosa inducida por dextrano sulfato de sodio (DSS) en ratones. Alimento Funct. 2015 , 6 , 3454–3463. [ Google Académico ] [ CrossRef ]
- Faghfoori, Z .; Shakerhosseini, R .; Navai, L .; Somi, MH; Nikniaz, Z .; Abadi, A. Efectos de un suplemento oral de alimentos de cebada germinada en el nivel de PCR en suero y signos clínicos en pacientes con colitis ulcerosa. Sanar. Promo. Perspectiva 2014 , 4 , 116–121. [ Google Académico ]
- Kanauchi, O .; Suga, T .; Tochihara, M .; Hibi, T .; Naganuma, M .; Homma, T .; Asakura, H .; Nakano, H .; Takahama, K .; Fujiyama, Y .; et al. Tratamiento de la colitis ulcerosa mediante alimentación con alimentos germinados de cebada: primer informe de un ensayo multicéntrico de control abierto. J. Gastroenterol. 2002 , 37 , 67–72. [ Google Académico ] [ CrossRef ]
- Barbalho, SM; Goulart, RDA; Quesada, K .; Bechara, MD; Carvalho, ADCAD Enfermedad inflamatoria intestinal: ¿pueden ayudar realmente los ácidos grasos omega-3? Ana. Gastroenterol 2016 , 29 , 37–43. [ Google Académico ] [ PubMed ]
- Scaioli, E .; Sartini, A .; Bellanova, M .; Campieri, M .; Festi, D .; Bazzoli, F .; Belluzzi, A. El ácido eicosapentaenoico reduce los niveles fecales de calprotectina y previene la recaída en pacientes con colitis ulcerosa. Clin. Gastroenterol Hepatol. 2018 , 16 , 1268–1275.e2. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Prossomariti, A .; Scaioli, E .; Piazzi, G .; Fazio, C .; Bellanova, M .; Biagi, E .; Candela, M .; Brigidi, P .; Consolandi, C .; Balbi, T .; et al. El tratamiento a corto plazo con ácido eicosapentaenoico mejora la inflamación y afecta los marcadores de diferenciación colónica y la microbiota en pacientes con colitis ulcerosa. Sci. Rep. 2017 , 7 , 7458. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chan, SSM; Luben, RN; Olsen, A .; Tjønneland, A .; Kaaks, R .; Lindgren, S .; Grip, O .; Bergmann, MM; Boeing, H .; Hallmans, G .; et al. Asociación entre la alta ingesta alimentaria del ácido docosahexaenoico de ácidos grasos poliinsaturados n-3 y la reducción del riesgo de enfermedad de Crohn. Alimento. Pharmacol El r. 2014 , 39 , 834–842. [ Google Académico ] [ CrossRef ]
- Bassaganya-Riera, J .; Hontecillas, R .; Horne, WT; Sandridge, M .; Herfarth, H .; Bloomfeld, R .; Isaacs, el ácido linoleico conjugado de KL modula las respuestas inmunes en pacientes con enfermedad de Crohn leve a moderadamente activa. Clin. Nutr. 2012 , 31 , 721–727. [ Google Académico ] [ CrossRef ]
- Seidner, DL; Lashner, BA; Brzezinski, A .; Banks, PL; Goldblum, J .; Fiocchi, C .; Katz, J .; Lichtenstein, GR; Anton, PA; Kam, LY; et al. Un suplemento oral enriquecido con aceite de pescado, fibra soluble y antioxidantes para el ahorro de corticosteroides en la colitis ulcerosa: un ensayo aleatorizado y controlado. Clin. Gastroenterol Hepatol. 2005 , 3 , 358–369. [ Google Académico ] [ CrossRef ]
- Feagan, BG; Sandborn, WJ; Mittmann, U .; Bar-Meir, S .; D’Haens, G .; Bradette, M .; Cohen, A .; Dallaire, C .; Ponich, TP; McDonald, JWD; et al. Ácidos grasos libres de omega-3 para el mantenimiento de la remisión en la enfermedad de Crohn. JAMA 2008 , 299 , 1690-1697. [ Google Académico ] [ CrossRef ]
- Halpin, SJ; Ford, AC Prevalencia de síntomas que cumplen criterios para el síndrome del intestino irritable en la enfermedad inflamatoria intestinal: revisión sistemática y metaanálisis. A.m. J. Gastroenterol. 2012 , 107 , 1474–1482. [ Google Académico ] [ CrossRef ]
- Farrokhyar, F .; Marshall, JK; Easterbrook, B .; E Irvine, J. Trastornos gastrointestinales funcionales y trastornos del estado de ánimo en pacientes con enfermedad inflamatoria intestinal inactiva: prevalencia e impacto en la salud. Inflamm. Intestino dis. 2006 , 12 , 38–46. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Barrett, JS; Gearry, RB; Muir, JG; Irving, PM; Rose, R .; Rosella, O .; Haines, ML; Pastor, S .; Gibson, PR Los carbohidratos de cadena corta, pobremente absorbidos en la dieta, aumentan el suministro de agua y sustratos fermentables al colon proximal. Alimento. Pharmacol El r. 2010 , 31 , 874–882. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Weber, AT; Shah, ND; Sauk, J .; Limketkai, BN Tendencias populares de la dieta para las enfermedades inflamatorias del intestino: afirmaciones y evidencia. Curr. Tratar. Opciones de Gastroenterol. 2019 , 17 , 564–576. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Pedersen, N .; Ankersen, D .; Felding, M .; Wachmann, H .; Végh, Z .; Molzen, L .; Burisch, J .; Andersen, JR; Munkholm, P. La dieta baja en FODMAP reduce los síntomas del intestino irritable en pacientes con enfermedad inflamatoria intestinal. Mundo J. Gastroenterol. 2017 , 23 , 3356–3366. [ Google Académico ] [ CrossRef ]
- Cox, SR; Prince, AC; Myers, CE; Irving, PM; Lindsay, JO; E Lomer, MC; Whelan, K. Carbohidratos fermentables [FODMAPs] Exacerbar los síntomas gastrointestinales funcionales en pacientes con enfermedad inflamatoria intestinal: un ensayo aleatorizado, doble ciego, controlado con placebo, cruzado, re-desafío. J. Crohns Colitis 2017 , 11 , 1420–1429. [ Google Académico ] [ CrossRef ]
- Prince, AC; Myers, CE; Joyce, T .; Irving, P .; E Lomer, MC; Whelan, K. La restricción de carbohidratos fermentables (dieta baja en FODMAP) en la práctica clínica mejora los síntomas funcionales gastrointestinales en pacientes con enfermedad inflamatoria intestinal. Inflamm. Intestino dis. 2016 , 22 , 1129–1136. [ Google Académico ] [ CrossRef ]
Traducción y adaptación de: Malinowski, B.; Wiciński, M.; Sokołowska, M.M.; Hill, N.A.; Szambelan, M. The Rundown of Dietary Supplements and Their Effects on Inflammatory Bowel Disease—A Review. Nutrients 2020, 12, 1423. https://doi.org/10.3390/nu12051423
Este artículo es un artículo de acceso abierto distribuido bajo los términos y condiciones de la licencia Creative Commons Attribution (CC BY) (http://creativecommons.org/licenses/by/4.0/ ).
Próximamente suplemento de Akkermansia muciniphila


